A problémák megoldását a szerves kémiában
Probléma 2 Döntetlen forgalmazásával elektronsűrűség
STI molekulák az alábbi vegyületek: a) 1-propanol; b) etilboran; c) 2-metilpropenal; g) 1-butént; d) 3,3,3-triklór-; e) izopropii; g) 2-metoxi-1-butén; h) 1-nitro-1-butént.
A molekulák, amelyek nem tartalmaznak poláros kötéseket, az elektronsűrűség egyenletesen oszlik az atomok közötti. Ha a molekulában legalább egy kötés poláris, a dipól E tekintetben meg ellensúlyozza más elektronikus kommunikációt. Eltolásai az elektronsűrűség lehet hatása által okozott sem a indukciós hatása a szubsztituens, vagy - abban az esetben, konjugációs pályák - mezomer hatása.
Induktív hatás - így az elmozdulások az elektronikus hírközlési sűrűség által okozott közeli poláris kötés. Ez jelöli a levél I. indukciós hatása a C-H önkényesen venni nullával egyenlő. Ha az a szubsztituens okozza elmozdulása az elektronok, vonz elektronok több, mint egy hidrogénatom, jóváírásra kerül negatív indukciós hatásának (-I). Ellenkező esetben, amikor a szubsztituens eltaszítja az elektronsűrűség több, mint egy hidrogénatom, egy pozitív indukciós hatása (+ I).
Mezomer hatása - az a képesség, hogy csatlakozzon egy szubsztituens pálya kölcsönhatás a szomszédos kettős kötés. Szubsztituenseket, amelyek révén a kölcsönhatás p-elektronok formájában magányos pár (p, π- konjugáció), azaz hozzájárulnak elektronsűrűség az eltolási irányára szomszédos többszörös kötést mutatnak + M hatása. Szubsztituensek, amelyek poláros többszörös kötést, lépnek π, π-kölcsönhatások (π, π-konjugáció) egy többszörös kötés, amely el van választva, hogy egy egyszeres kötés, és kiszorítja az elektronsűrűség. Ezek egy olyan -M hatást.
Polarizáció és poláris kötések, és a polarizált eredményeként induktív és mezomorf hatást kötések azt jelzik, részleges díjak (δ- és δ +) a megfelelő atomokkal. Sőt, egyes kötéssel használatra nyilak mentén a linkeket, és a többszörös kötések - ívelt nyilak kommunikáció az adott atom (vagy egy egyszeres kötés, elválasztó konjugált többszörös kötést).
Probléma 3. Hasonlítsa össze a reakció sebességét elektrofil
Amellett, hogy a következő vegyületek: etilén, propén, 3,3,3-trifluorpropén, 2-metil-propén.
Sebesség elektrofil addíciós reakciókat szén-szén kettős kötéseket vagy reaktivitás reakciók Ad E. függ nukleofil jellege ezt a kapcsolatot. Nukleofilságát, azaz A véradási képesség egy elektronpár viszont arányos az elektron sűrűség ebben a tekintetben. Ezért összehasonlítjuk a sebesség szükséges, hogy összehasonlítsa a hatását szubsztituensek (atomok és csoportok a atom) az elektronsűrűség a kettős kötés, azaz határozza meg az irányt és relatív nagysága az elektronikus hatásokat.
CH 2 CH 2 CH 3 CH CH 2 CH 2 CHCF CH3 C CH2
Az etilén-molekula egy kettős kötés a kapcsolódó szénatom csak hidrogénatomok, amely induktív hatást feltételezzük, hogy 0. Így, az etilén molekula úgy tekinthető, mint a standard, amelyhez lehet elhelyezni
számának minden más kapcsolat.
A molekula propén metilcsoport mutat + I-
hatás, azaz a Ez egy csoport, mely növeli az elektronsűrűség a kettős kötés, és ezért növeli a reaktivitás propén a elektrofil addíciós reakció összehasonlítva a etilén kapacitása.
Még inkább reaktív, mint az etilén és a propén, 2-metil-propén van. mert a molekula két elektrondonor szubsztituenst kettős kötés.
A molekula 3,3,3-trifluorpropén három fluoratommal, mivel ezek nagyobb elektronegativitású képest a szénatommal mutatnak -I-hatásokat, melyek hatására a szénatommal, amelyhez kapcsolódnak egy nagy hiány az elektronsűrűség. Ez teszi metil erős elektron akceptor. Ezért, 3,3,3-trifluorpropén aktiválva elektrofil kívül, azaz Okok
giruet elektrofil reagensekkel jelentősen lassabb, mint az etilén.
Így ezek a vegyületek lehetnek elrendezve egy sorban, hogy növelje a reaktivitás reakciókban
3,3,3-trifluorpropén
Probléma 4 összehasonlíthatja a reaktivitás a következő
vegyületek elektrofil szubsztitúciós reakciók: benzol, toluol, benzaldehid, a fenol, a meta - nitro-benzaldehidet.
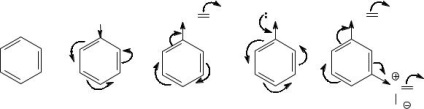
Reaktivitás aromás vegyületek elektrofil szubsztitúciós reakciók függ nukleofil - a képesség, hogy adományozni egy elektronpár, ami függ a teljes elektronsűrűség az aromás magnak. Szubsztituensek elektron okazyvyuschie fellépés az aromás magon, fokozott elektronsűrűség rajta, és ezáltal növelik a reaktivitást a vegyületek, azaz aktiválja őket elektrofil támadással. Elektronvonzó szubsztituens, csökken az elektronsűrűség az aromás gyűrű, meghatalmazotti dezaktiváló helyettesitők. Ezért, hogy összehasonlítsuk a reaktivitás a szükséges meghatározni a szubsztituensek természetétől, hogy nevezze meg az elektronikus hatások, amelyek specifikusan hat a helyettes aromás gyűrű.
A molekula toluol metil-szubsztituenst mutat + I-hatás, azaz a Ez egy elektron donor. Ezért, míg a toluol-benzol vegyület aktiválódik, és reagáltatjuk elektrofilekkel gyorsabb.
Molecule benzaldehid deaktivált elektrofil szubsztitúciós, mint formilcsoport egy elektronvonzó szubsztituens (dezaktivátor) megnyilvánuló tekintetében a benzolgyűrű és a -I-, és -M hatása.
Még több hatástalanított mint benzaldehid, egy meta - nitro. mert amellett, hogy az elektron-formil-csoport a molekulában, és még jelen egy erős dezaktiváló szubsztituens, például nitrocsoport (-I- és -M hatás).
A legaktívabb vegyület a fenol. hidroxil-csoport, amely annak ellenére, hogy -I-hatást fejt ki erős hatást gyakorol a teljes elektron aromás mag egy igen hatékony p-π- konjugáció (M + >> - I).
Így ezek a vegyületek vannak elrendezve az alábbi emelkedő reaktivitás elektrofil szubsztitúciós reakciók:
meta -nitrobenzaldegid
Probléma 5. összehasonlítása savas tulajdonságokkal következő soedi-
Neny: a) a metán és nitro-metán; b) etanol és 2-klór-etanol; c) metanol és metil-amin; g) ecetsav és aceton; d) etanol, és a fenol. Válaszát indokolja.
A savas tulajdonságokat az elmélet szerint a Bronsted-nyilvánul meg a vegyületek képességét a lép egy reverzibilis kölcsönhatás protonakceptor - bázis - konjugált bázisa, hogy egy olyan bázist képezzenek, és a konjugált sav meghatározzuk, és a helyzetét ez az egyensúly. Minél erősebb az egyensúly jobbra tolódott, az erősebben savas tulajdonságokkal. Hasonlítsuk össze a savas tulajdonságait a különböző savak minőségileg összehasonlításával a pozícióját a sav-bázis egyensúlyok ezen savak bármilyen bázissal. Az egyensúlyi helyzet függ a viszonylagos stabilitását a konjugált bázis, így összehasonlítani a tulajdonságai különböző savas vegyületek értékeléséhez szükséges stabilitást a konjugált bázisok. A stabilabb konjugált bázis,
így gyengébb, ezért az erősebb sootvetst-
vuyuschaya sav. A stabilitás a konjugátum bázisokkal savak esetében, amelyeknek nincs töltés negatív töltésű részecskék - anionok egyaránt érintik intramolekuláris tényezők és külső tényezők, mint például, szolvatáció. Ha az oldószer nincs megadva, figyelembe véve a függőség a stabilitását konjugált bázisaik csak belső tényezők, amelyek magukban foglalják az első elektronikus: nevezetesen, hogy az a szomszédos atomok és csoportok stabilizáló a negatív töltésű részecskék. Ez lehet egy negatív indukciós hatása szubsztituens, amely csökkenti a negatív töltés miatt az összehúzódás az elektronsűrűség, vagy negatív mezomer hatása jelzi delokalizációja az elektronsűrűség, és a negatív töltés.
a) a metán és nitro-metán
Azt ábrázolja a sav-bázis egyensúly számára ezek a vegyületek minden olyan bázis (B).
Következésképpen, nitrometil anion sokkal stabilabb, mint a metil-anion. Ezért nitrometán egy erősebb sav, mint a metán. Valóban, nitro-metán, mint a sav több mint 30 nagyságrenddel erősebb, mint a metán.
b) etanol és 2-klór-etanolt
A molekula etanolt és 2-klór-etanol vannak különböző hidrogénatom, de a sav tulajdonságainak ezen vegyületek jelenléte miatt a hidroxilcsoport O-H, mint a sav, sokkal hatásosabb, mint a C-H-acid (képesség atomok negatív töltést hordozó a helyzetüktől függően a a periódusos rendszer abban az időszakban növeli balról jobbra). Ezért, a sav-bázis egyensúly ezen vegyületek a következők:

CH 3 CH 2 O H + BCH 3 CH 2 O + B H
CH 2CH 2O H + BCH 2CH 2O + B H
2-Hloretoksid anion ellenállóbb, mint etoxid anion, mint klóratom, egy fejlődő -I-hatást, húzza elektron sűrűsége σ-kötések, csökkenő az elektronsűrűség a oxigénatom, és ezáltal gyengíti az bázicitása. Következésképpen, 2-klór-etanol erősebb sav, mint az etanol.
c) metanol és metil-amin
O-H-sav, mint például N-H-sav egy erősebb sav, mint a C-H sav, így a sav-bázis egyensúly a metanolt és metil-amin a következők:
CH 3 NHH + BCH 3 NH + B H
Metoxid anion sokkal stabilabb részecskeméret, mint metil-amid-anion, mert több elektronegatív oxigén atom könnyebb „tartja” a negatív töltés, a kevésbé elektronegatív nitrogénatom. Ezért metoksidanion konjugátum gyengébb bázis, mint az anion-metil-amid, és a metanol - egy erősebb sav, mint metil-amin.
g) ecetsav és aceton
A sav-bázis egyensúly, hogy ecetsav és aceton a következőképpen: