kémiai egyenletek
A törvény tömegmegmaradás anyagok, külső MV Lomonoszov 1756 következőképpen szól:
Mass anyagok reagálatlan egyenlő súlyt eredményeként keletkező anyagokat benne.
Mass anyag hordozók anyagok atomjait kémiai elemek, amelyek állnak a két anyag bekerül a reakció (reagensek), és kialakítva ennek eredményeképpen az új anyagok (reakciótermékek). Mivel a kémiai reakciók atomok keletkeznek n nem semmisülnek meg, hanem csak az ő átcsoportosítása, akkor nyilvánvalóvá válik, amely nyitva MV Lomonoszov és később megerősítette Lavoisier törvény.
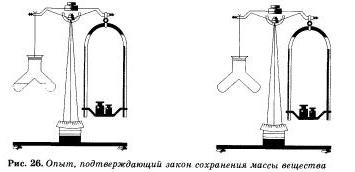
Érvényességét a törvény megőrzése anyag tömege könnyen látható egy egyszerű tapasztalat. Tedd egy kis flaska vörös foszfor, majd zárja be a dugót, és mérjük az egyensúlyt. A lombikot ezután óvatosan felmelegszik.
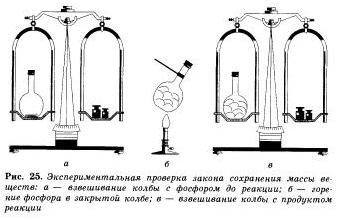
Az a tény, hogy volt egy kémiai reakció. Mi világos lesz a megjelenése sűrű fehér füst a lombikban tagjai foszfor-oxid (V). amely alakult, amikor a foszfor az oxigénnel reakcióba lépve. A hipertrófia állatban a lombikot a reakció termékei a azt látjuk, hogy a tömege anyagot a lombikban változott, bár foszfor konverzióval a megfelelő oxid.
Ezt a következtetést tett minket, és közben egy egyszerű, de nagyon vizuális élményt. Egy speciális edénybe öntsük külön sósav és lúgos oldattal, pl nátrium-gidrokspda. Ahhoz, hogy egy alkáli-oldatot adjunk hozzá néhány csepp indikátort - fenolftalein, így a megoldás pedig egy bíbor színű. Zárjuk a dugót eszközt, az egyensúlyt a súlyokat a skálán jegyzet tömeget, és majd egyesíteni megoldásokat. Bíbor színeződés eltűnik, mivel a sav, lúg és reagáltatjuk egymással. A tömege az edényt a reakció előállított termékeket nem változott.
Az e jogszabály alapján íródott kémiai kínál, azaz megegyezik a kémiai reakciók a kémiai szó - képleteket.
A kémiai egyenlet az úgynevezett feltételes felvétel egy kémiai reakció kémiai képletek és matematikai szimbólumokat.
A bal becsület egyenlet rögzített képlet (képlet) anyagok, nem reagált, csatlakoztasd a plusz jel. A jobb oldalon az egyenlet van írva az általános képletű (A képlet) képező anyagokat szintén csatlakozik egy plusz jel. Részei között az egyenlet fel a nyíl. Ezután keresse meg a koefficiensek - a néző anyagok képletek, hogy a atomok száma az azonos elemeket a bal és jobb oldalán az egyenlet egyenlő.
Írunk, például a következő reakcióegyenlet:
Mivel a oxigénatomok számának az első rész kétszerese legyen a bal oldali, tudjuk írni a víz aránya 2 általános képletű:
2H2O -> H2 + O2
De most a bal oldalon az egyenlet volt négy hidrogénatomot, és a megfelelő, hogy a megmaradt két. Hogy kiegyenlítse a hidrogénatomok számának írni a képlet jobb oldalán tényezőjeként 2. Mivel azonosítjuk az atomok számát minden egyes eleme a bal és jobb oldalán az egyenlet, akkor cserélje ki a nyíl a jele az egyenlőség:
2H2O = 2H2 + O2
Most már talán látod, hogy miért ezt a rekordot hívják az egyenletet.
Kémiai reakciói az egyenleteket úgy határozza meg a típusú reakció. Tehát a reakció a fent tárgyalt tárgya a bomlási reakció I, azaz az ilyen, melyek egy komplex anyag il kialakítva két vagy több új anyagok egyszerű vagy komplex, de egyszerűbb készítmény.
Bomlásakor, például vas-hidroxid (III) vannak kialakítva a vas-oxid (III) és a víz:
Kémiai reakciók nevezzük ellentétes típusú reakciók vegyületet. A reakcióban a vegyület adja meg egy vagy több egyszerű vagy összetett anyagokat, amelyek közül az egyik képez bonyolultabb anyagot.
Például, a hidrogén és az oxigén, amikor égő kombinálódva alkotják a víz:
Arra utal, hogy a reakció-vegyület és a korábban tárgyalt kapcsolati előállítására szolgáló reakciót a vas-szulfid (II) vasport és kén. Érdekes, hogy a kapcsolási reakció, és a bomlási reakció kíséri ellentétes hőhatás: a vegyület reakciója általában exoterm. és a bomlási reakció - a endoterm.
Ha réz-szulfát-oldatot (II), hogy csökkentse a vas klip, nagyon hamar kiderül piros miatt kicsapjuk rajta réz-szulfát és a vas (II) megy oldatba:
CuSO 4 + Fe = FeSO4 + Cu
Felvettük egyenlet szubsztitúciós reakció, azaz egy olyan reakcióban, amelyben az atomok végrehajtása egyszerű anyagnak a szubsztituensek ne elemek bonyolult dolog.
Ennek eredményeként a reakció során két új anyagok - egyszerű és összetett.
A metatézis reakciók közé tartoznak azok, amelyekben a két összetett anyagok cserélnek alkotórészeire.
Például, egy oldathoz, amely réz-szulfát Réz-szulfát (II) oldatot mn néhány csepp edkoyu-hidroxid - nátrium-hidroxid, esik kék csapadékot réz-hidroxid (II). Ez képezi egy további komplex anyag - oldható sóját nátrium-szulfát:
Ha az eredményül kapott csapadékot túlfeszültség kénsav oldattal, majd megfigyeljük a csapadék feloldódása eredményeként kapott másik kicserélődési reakció:
Cu (OH) 2 + H2SO4 = CuSO4 + 2HOH
Ezért, az egyenlet azt mutatja, egy kémiai reakció, mely anyagok reagálnak, és mely anyagokat ily módon alakul ki, amelyben a mennyiségi viszonyok vannak, és milyen a reakció típusát.
Például, az egyenlet
4Al + 3O2 = 2Al2O3
Ez azt jelzi, hogy a vegyület kapott reakcióelegyet négy mól alumínium reagáltatjuk három mol oxigént, és ezáltal két mól alumínium-oxid.
1. A kémiai egyenlet.
2. reakciói bomlás.
3. A reakciókat kapunk.
4. szubsztitúciós reakciók.
5. csere reakciókat.
Record formájában kémiai egyenletek a következő mondatokat: a) A kalcium-karbonát képződik pörkölés kalcium-oxid és a szén-oxid a (IV)
b) A reakciót a foszfor-oxid (V) előállított víz foszforsav. Milyen típusú ezek a reakciók? Melyikük lesz exo- és endoterm mi?
Tedd az egyenlet a következő rendszereket, és válassza ki, hogy milyen típusú reakció:
Az képletek anyagok írni a nevüket. Írja le a kémiai reakciók az alábbi rendszerek:
a) foszforsav + nátrium-hidroxid -> nátrium-foszfát + víz;
b) nátrium-oxid + víz -> nátrium-hidroxid;
c) vas-oxid (II) + Alumínium -> alumínium-oxid + vas;
g)-hidroxid, réz (II) -> oxid, réz (II) + víz.
Határozza meg a típusú reakció.
Ami azt mutatja, a következő kémiai reakció egyenlete:
Milyen mennyiségű hidrogén reagáltatunk 1 mól vas-oxid (III)? Mi térfogat hidrogén reagál 1 mól vas-oxid (III)? Mi a vas mennyiségét ilyen módon? Hány vízmolekulák ugyanakkor van?
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.