Valence héja egy atom (oepvo)
elektronpár taszítási módszerrel
BC módszer alapján meghatározzuk a szögek közötti kötéseket és a torzítás hatása alatt a nem kötő elektronpár. Feltételezzük, hogy van egy taszítási elektronpár vegyértékei héj (OEPVO).
A fizikai módszer alapján OEPVO által javasolt Gillespie és Nyholm, határozza meg a Pauli-elv: tekintettel arra, hogy az atomi foglal egy bizonyos régióban a tér, azt lehet mondani, hogy ezen a területen is csak egy elektronpár, a másik pedig tolta ki a területen.
Így, a fej helyzete OEPVO módszer abból áll, hogy a elektronpár a vegyérték héj egy atom (molekula) taszítják egymást és a körül vannak elrendezve egy atom az ilyen módon (az ilyen szögek), hogy ez a taszítás minimális.
Jelöljük molekulát (vagy fragmense) ABN. ahol A - a központi atom, B - Side atom (ligandum), n - a atomok száma párban körül A. Elektronikus körüli atom lehet kötődés (B-atom), és a nem kötő vagy páratlan (X helyén, és E). Ezután atom elektron pár egy molekulában ABN A (tekintve a nem kötő pár) is ki lehet jelölni Em Ahn .Ha etomobschee száma elektron párok egyenlő n + m. A formula figyelembe veszi csak azok elektron párokat, amelyek s - helyzetben, hogy az atom az A, azaz az elektronikus sűrűségű célja a kommunikációt a atomokkal B tengely; all-E pár is a s-helyzetben. A módszer OEPVO tekintve hibridizáció elfogadja, hogy az összes elektron párok foglalják el ugyanazt a teret. Az egyszerűség kedvéért úgy, hogy azok gömbök sugara azonos legyen. Nyilvánvaló, hogy ha a méretek minden pár elektronok körül atom azonos, ezek alkotják a helyes összeg.
OEPVO módszer meghatározza a változás a formák molekulák és a torzítás közötti szögek kötvények képest ideális miatt nem megosztott elektronpár és többszörös kötések, és a kölcsönös elrendezése egyenlőtlen atomok és elektronpár. Ahhoz, hogy ezt a módszert használja, akkor először meg kell határozni:
1) teljes számának elektron pár atom;
2) száma - megfelelő alakra ábra alakított elektrondonor felhők;
3) Ezután meg kell megállapítani, hányan kötelező, nem kötelező érvényű és több. A legkényelmesebb módja ez megtehető segítségével az áramköri BC a molekula;
4) Ezután meghatározzuk a geometria a molekula.
Felvennénk a fő polozheniyametoda OEPVO.
1. a nem kötő elektronpár taszítják erősebb, mint a kötési, így torzítják az alak a molekula. Ha például, a készítmény az elektron párok mi molekula típusa AX3 (NO3 -) és AX2 E (NO2 -), ezek formában 1. szabály a következő
(Ábra 3.15.):
Ábra. 4.15.Forma molekulák ha hibridizáljuk sp2
2. Mivel a nem kötő elektronpár taszítják egymást erősen, hogy ha több, nem kötelező elektronpár található egy maximális távolság egymástól. Például, az AV4 típusú molekulák elektronpár ax4 típusú E2 (HeF4)
(. Ábra 3.16, a) előnyös lesz sík formában (sp3 hibridizációs d 2), és a típus AB2 molekulák elektronpár AX2 E3 (például, HEF2) - lineáris (ábra 3.16, b.).
Az utóbbi esetben, a szögek között a párokat az egyenlítői síkban nagyobb, mint a közte és a tengely (120 és 90 0), úgy, hogy a kölcsönös taszítás E-E síkjában kisebb.
3. A nagyobb elektronegativitási terminális atom (B), annál inkább taszítják a nem kötő elektronpár, azaz szögek BAB kevesebb. Például, a molekulák, amelyek elektron-párok Ax3 E-típusú (NH3 és NF3) van szögek: Ð HNH = 107 °, és Ð FNF = 102 °, ami megfelel a EA (n) = 2,1 és EO (F) = 4.
E E 5s 5p 5d Xe * X X X X E
Ábra. 4.16 is. Sun rendszert, és szerkezeti képlete a molekula XeF4
E E E 5s 5p 5d Xe * x x F 2p ½ E ¾ Hye ¾ E ½ E 2s F F F ábra. 4.16, b. Sun rendszert, és szerkezeti képlete a molekula XeF2
4. Több kommunikációs taszítják több, mint a hagyományos. Például, a molekula HeO3 F2 (. AB5 típusú trigonális kettős gúla, elektronpár AH5 + 3π) három oxigénatomot a (OHeO szög = 120 °), mert kettős kötést, és a molekula UO2 F5 -3 (típus AB7 - ötszögű kettős gúla elektronpár AH7 + 2π) van egy lineáris elrendezése oxigénatomok, mivel a szögek FUF = 72 °, azaz kisebb, mint 90 °.
5. A torzítás közötti szögek kötések hatása alatt a nem megosztott elektronpár nagyobb minél nagyobb a szám a szabad SA a vegyérték héj egy atom, és a nagyobb méretek. Például, hasonló NH3 molekulák. PH3. AsH3 szög ebben a sorban csökken növekvő számú vegyérték AO (lapon. 4.3). Ugyanez mondható el a molekulák H2 O, H2 S, H2 Se.
Hatás a számát vegyértékkötés szög AO
Ábra. 4.17. A szerkezet a molekula
Molecule SOCI2. Vegyünk egy kénatom a gerjesztett állapotban, hogy három s-kapcsolatot a klór atomok (kettő) és oxigén (önmagában). Egy másik példa a páratlan elektron a kialakulását a p-egy oxigénatomon (ábra. 3.18). A számú elektron pár, S- helyén található a nem kötő 3s-AO, a kénatom - Négy: E Ax3 + p-kötés (sp3 hibridizációs). Ax3 E ad Tetrahedron konfigurációs torz a nem kötő elektronpár E. hiányában egy atom helyén E számunkra helyett tetraéder trigonális piramis
(Táblázat. 3.4). Minden szögek kevesebb, mint a tetraéderes (Ð109,28 ° C), és ezen túlmenően meg lehet jósolni, hogy ClSCl szög kisebb lesz, mint ClSO összhangban a 4. szabály.
Így OEPVO módszer megjósolni a geometria a molekulák. Azonban jobb, hogy nem minden esetben. A legtöbb esetben ez az elmélet kovalens vegyületek s- és p-elemek.
A száma lokalizált elektron pár Center
atom és térbeli konfigurációját a molekulák ABN
s- elektron párokat egy atom A
A készítmény és a molekula alakja és az elektron párokat
A polaritását kovalens kötés. Az elektromos tulajdonságok. Atomok és molekulák tartalmaznak elektromosan töltött részecskék - elektronok (# 275;) és a nucleus töltés + Z. Mivel az elektronok gyorsan mozognak, egy viszonylag nagy régió a mag körül, hogy meghatározza a villamos tulajdonságait az atomok és molekulák kell bevezetni a „súlypontjának” vagy negatív pólus, és a pozitív elektromos töltés. Nyilvánvaló, hogy a atomot ezek ugyanahhoz az atomhoz és apoláros. Az ilyen helyzet fordul elő bizonyos molekulák: kétatomos (A2) és a nagy-szimmetria többértékű (CH4 BF3 SF6, stb ....).
3s 3p 3d S * E x x x o
Ábra. 4.18. Sun rendszert, és szerkezeti képlete
Ha a „súlypontja” a negatív és a pozitív töltés nem azonos, akkor a poláris molekula alkot dipól, amely jellemzi a dipólusnyomatékkal abszolút értéke, amely
ahol # 948; - egy töltött pólus l - távolság a pólusok között, a nyíl azt jelzi, hogy a dipólus - vektor mennyiség.
Az m érték mérése SI-egységek KL · m (coulomb méterenként). A tipikus értékek lehet becsülni az elektron töltése ( „10-19 Cl), és a hossza a atomközi távolsági (” 10-10 m), azaz, az általuk képviselt „10-29 Cl · m. A kényelem, a különleges egység dipolusmomentum - Debye (D):
Jellemzésére a dipól de a nagyságát és irányát, az effektív költség # 948; l eff és a hossza a dipólus. Ezek az értékek a különböző mértékben különböző oxidációs fokú és kötéshossz, ill.
A dipólus momentum tartalmazó molekulák poláros kötéseket, meghatározott összegeként a dipólusmomentum a kötések. E folyamat során a vektor hozzáadásával a dipólusok a hivatkozások (a kémiai szakirodalomban a pozitív iránya a dipól irány venni a „+” „-”). Az összeget a két dipólus kapjuk az átlós a téglatest épített rájuk. Például, a szögletes molekula AB2:
Ha dipólusok, mint 2, akkor hajtogatják őket egymás után párokban. Nyilvánvaló, AB2 lineáris molekulákat. lapos háromszög - AB3. tetraéderes és tér - AV4. trigonális bipiramis - AB5. oktaéderes - AB6. dipólmomentum nulla.
4.5 táblázat mutatja, a dipólus momentum az egyes anyagok, és a 4.6 táblázat - hatásos töltetek (egységekben elektron töltése) az atomok egyes vegyületek.
Hatékony díjak jellemző aszimmetria az elektron felhő, hagyományos, például a delokalizált elektron felhő, és nem lehet „osztott” a magok közötti; úgy, hogy a díj függ a meghatározási módszer.
A dipólusmomentumának egyes molekulák
Mivel az intézkedés a polaritását kapcsolat vagy molekulák gyakran használják értéke fokú iontartalma (i) vagy covalence (K).
Így, ha a molekulában HCI QCL = 0,2qe. és WCL = -1, akkor i = 0,2, azaz iontartalma 20%, és a mértéke kovalenciája - 80%.
A nagysága iontartalma kötés A-B is becsülhető a különbség electronegativities az atomok (DEO) (Táblázat. 4.7
Ábra. 4,19).
Ábra 4.19 kb fejezi Pauling létre a kapcsolat a ionos jellege kommunikáció és a különbség a electronegativities elemek. Az ábrából következik, hogy csak a-fluoridok, alkáli- és alkáliföldfém-kötést lehet tekinteni közel a ion.
Mivel az alkálifém-fluoridok körülbelül 3, majd
i »90%, ami közel van a tisztán ionos kötéssel.
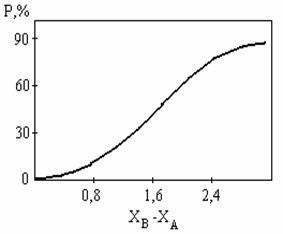
Ábra. 4.19. A függőség az ionizáció mértéke miatt a különbség
elemek elektronegativitási (Pauling)
A függőség az ionizáció mértéke a különbség
Ez a kapcsolat nem lineáris, és a számok maguk csak hozzávetőleges, mint az összes függőségek társított elektronegativitása az elem.
Mivel a mennyiségek # 967; és i fontos jellemzői az atomok és kémiai kötések a vegyületek, az is hasznos, hogy egy matematikai képlet a kommunikációt közöttük:
Ez a képlet nem célja, hogy pontos, mint az értékeit ionos jellege és elektronegativitása, hanem gyakorlatilag hasznos, amikor összehasonlítjuk ionos jellege kémiai kötéseket.
A keresés, megtalálja az információkat a helyszínen.
Oldal keletkezett 0,04 másodperc.