Biológia és Kémia
Tartalmazó anyagok a molekulában egy vagy több karboxilcsoporttal nevezett karbonsavak.
O
//
C csoport atomok nevezzük karboxilcsoport vagy egy karboxilcsoport.
# 92;
OH
Szerves savak, amelyek a molekulában egy karboxilcsoportot tartalmaznak egybázisú. Az általános képlet fenti savak RCOON.
Karbonsavak, amelyek két karboxilcsoportot nevezzük kétbázisú. Ezek közé tartozik, például, az oxálsav és a borostyánkősav.
Ott és több-bázisú karbonsavak, amelyek több mint két karboxilcsoportot. Ezek közé tartozik, például, a hárombázisos citromsav. Jellegétől függően a szénhidrogén-csoport karbonsavak vannak osztva korlátozó, telítetlen, aromás.
Limit, vagy telített karbonsavak, például propánsav (propionsav) sav vagy a jól ismert borostyánkősav.
Nómenklatúra és izoméria
karbonsav képződik a cím nevét megfelelő alkán (alkán azonos számú szénatomot tartalmaznak a molekulában) azzal a kiegészítéssel, utótag Férfi, lezárás -edik szót és a sav. A számozás az szénatomok indul a karboxilcsoporttal. Például:
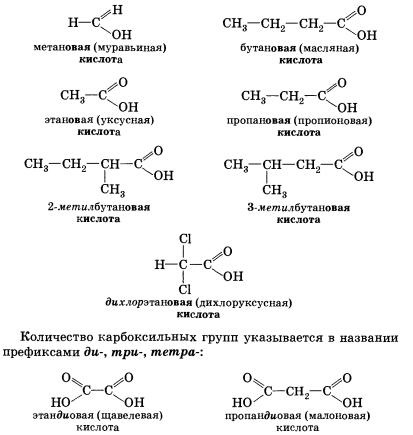
Sok sav és történelmileg vagy triviális nevek (fülre. 6).
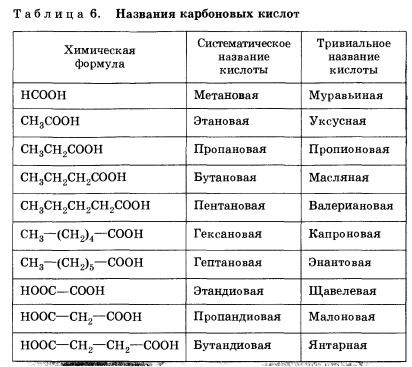
Összetétel korlátozó monokarbonsavak tükröződni fog az általános képletű CnH2n O2, vagy Cn + 1 H2N COON vagy RSOON.
Fizikai tulajdonságok korlátozzák monokarbonsavak
Alsó savak, azaz, savak, amelyek egy viszonylag kis molekulatömegű molekula, amely legfeljebb négy szénatomot tartalmazó, - .. A folyadék szúrós szagú jellemző (emlékszik ecetsav szagú). A savak, amelyek 4-9 szénatomot tartalmaznak, - viszkózus, olajos folyadék kellemetlen szag; amelyek több mint 9 szénatomot tartalmaznak molekulánként - szilárd anyagok, amelyek nem oldódnak vízben. Forráspont hőmérséklet korlátozása szén-O egybázisú savak növeli a szénatomok száma a molekulában, és így a növekvő relatív molekulatömeg. Így például, a hangyasav forráspont 101 ° C, ecetsav - 118 ° C, propionsav - 141 ° C-on
A legegyszerűbb karbonsav - hangyasav HCOOH. miután egy kis relatív molekulatömeggel (46) normál körülmények között egy folyadék forráspontja 100,8 ° C Ugyanakkor, a bután (MR (C4H10) = 58) azonos körülmények között gáz halmazállapotú, és forráspontja a -0,5 ° C-on Ez az eltérés forró pontokat, és a relatív molekulatömege miatt kialakulását karbonsav dimerek, amelyben két-molekulákat köti össze két hidrogénkötések. A előfordulása hidrogénkötések világossá válik, ha figyelembe vesszük a molekulák szerkezete a karbonsavak.
Hangyasav és ecetsav oldódnak a vízben végtelenségig. Nyilvánvaló, hogy a növekedés a atomok számát a szénhidrogéncsoport karbonsavak csökkenti oldhatóságát.
Közös tulajdonságok jellemző az osztály a savak (szerves és szervetlen), jelenléte miatt a molekulák a hidroxil-csoport-tartalmú erősen poláros atomok közötti kötés a hidrogén és az oxigén.
1. A disszociációs alkotnak hidrogén kationok és anionok a savmaradék.
karbonsav disszociációs egyensúlya balra mozog, a túlnyomó többségük - gyenge elektrolitok. Mindazonáltal, savanyú ízű, mint például a hangyasav és ecetsav magyarázható disszociációja a hidrogén kationok és anionok a savas maradékok.
Nyilvánvaló, hogy a jelenléte a molekula karbonsavak „savas” hidrogénatom, t. E. A hidrogén a karboxilcsoport miatt más jellemző tulajdonságok.
2. Kölcsönhatás fémek állt a elektrokémiai feszültség sorozat hidrogénatom. Így, vas visszanyeri hidrogénatom ecetsavból:
2CH3-COOH + Fe -> (CHgCOO) 2Fe + H2
3. Kölcsönhatás bázikus oxidok képezve sót és vizet:
2R-COOH + CaO -> (R-COO) 2Ca + H20
4. Kölcsönhatás a fém-hidroxidok, így a só és víz (semlegesítési reakció):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca (OH) 2 -> (R-COO) 2Ca + 2H20
5. Kölcsönhatás sókat gyengébb savak, a kialakulását az utóbbi. Például, az ecetsav, a sztearinsav kiszorítja a nátrium-sztearát és a kálium-karbonát szén.
6. reakció karbonsavak alkoholokkal képezett észterekké - már ismert reakciót ete-rifikatsii (az egyik legfontosabb reakciók jellemző karbonsavak). A reakciót a karbonsavak alkoholokkal katalizált hidrogén kationok.
Az észterezési reakció reverzibilis. Eltolódik az egyensúly az észter képződését jelenlétében vodootni-cerned eszközöket és az étert eltávolítva a reakcióelegyből.
A inverz reakció észterezési, amely az úgynevezett észter-hidrolízissel (reakciót vízzel az észter), sav és alkohol képződik. Nyilvánvaló, hogy reagál karbonsavakkal, azaz, adja meg a észterezési reakciót és a többértékű alkoholok, például glicerin ..:
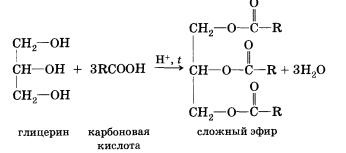
Minden a karbonsav (kivéve hangyasav) együtt egy karboxilcsoportot tartalmaz, a molekulák a szénhidrogén-maradék. Természetesen, ez nem befolyásolja a tulajdonságait savak, melyek természete határozza meg a szénhidrogén-maradék.
7. reakciói ragaszkodás a kettős kötés - jönnek telítetlen karbonsav; így például, a reakció a hidrogén mellett - hidrogénezés. Hidrogénezése olajsav, sztearinsav alakított határértéket.
Telítetlen karbonsav, mint a más telítetlen vegyületek, halogénatom kapcsolódik a kettős kötés. Így például, akrilsav elszíneződik brómos vizet.
8. szubsztitúciós reakciók (halogén) - a csatlakozhat a marginális karbonsav; például oly módon, ecetsavat klórral állíthatók elő különböző klórozott sav:
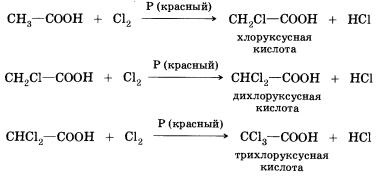
Amikor a halogénezésével karbonsavak, amelyek egynél több szénatom az szénhidrogén maradék képezhet termékek különböző pozíciókban a halogén a molekulában. Amikor a reakció megy végbe a szabad gyökös mechanizmussal lehet szubsztituálva bármely hidrogénatomok egy szénhidrogéncsoport. Ha a reakciót jelenlétében kis mennyiségű vörös foszfor. ez a szelektív - csak hidrogén- helyettesített a-helyzetben (a legközelebbi a funkciós csoport szén-atomok) a-molekula. Ennek oka a szelektivitás, megtudhatja a tanulmány kémia az egyetemen.
Karbonsavak képeznek különböző működőképes származékai helyettesítve a hidroxilcsoport. A hidrolízis E származékok újonnan kialakított karbonsavészter.
Karbonsavakat úgy állíthatjuk elő, oxidáló aldehidek és primer alkoholok.
Az aromás karbonsavak az oxidációs a benzol-homológokat.
Hidrolízise különböző származékok karbonsavak is vezet a termelés a savak. Így, a hidrolízis során az észter képződött alkohol és karbonsav. Amint a fentiekben említettük, az észterezési reakció és hidrolízis, savas katariliziruemye reverzibilis. Az észter hidrolízise vizes lúgos oldattal végbemegy visszafordíthatatlanul, amely esetben egy észter sav nem képződik, és sója. A nitrilek hidrolízisét amidok keletkeznek először, melyeket ezután alakítjuk sav. Keletkezett karbonsav előállítására egy magnézium-szerves vegyületek szén-monoxiddal (IV).
Egyedi képviselői karbonsavak és azok jelentését
Hangyasav (metán) sav HCOOH - folyadék, szúrós szagú, és forráspontja 100,8 ° C, vízben könnyen oldódik. A hangyasav mérgező, bőrrel érintkezve égési sérülést okoz! Szúró folyékony szekretált hangyák tartalmazza ezt a savat. Hangyasav egy fertőtlenítő tulajdonságúak, ezért úgy véli, annak alkalmazása az élelmiszer, a bőr és a gyógyszeripar, gyógyszer. Azt is használják textilfestékként és papír.
Ecetsav (etánsav) CH3COOH - színtelen folyadék, szúrós szaga, összekeverjük vízzel minden tekintetben. A vizes oldatokat ecetsavat néven forgalmazzák ecet (3-5% -os oldat) és ecet (70-80% -os oldat), és széles körben használják az élelmiszeriparban. Ecetsav - jó oldószer a sok szerves anyagot, és ezért használjuk festés a barnító iparban, a festékiparban. Továbbá, az ecetsav a nyersanyag számára sok fontos műszakilag szerves vegyületek, például, ez alapján állítjuk elő anyagokat alkalmazhatjuk gyomirtásra - herbicidek.
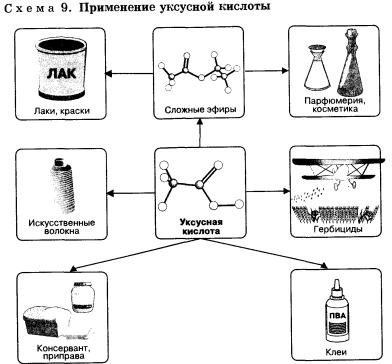
Az ecetsav fő komponense ecet, ami annak köszönhető, hogy a jellegzetes szag neki. Ez etanol oxidációs termék képződik, és ennek a bor tárolására, hogy a levegő.
A legfontosabb képviselői a magasabb korlátot monokarbonsavak palmitinsav és sztearinsav S15N31SOON S17N35SOON savat. Ellentétben ezeket az alacsonyabb szilárd sav anyag rosszul oldódik vízben.
Azonban, ezek sói - sztearátok, és palmitátok, - oldható és mosószer fellépés, így azok az úgynevezett szappanok. Nyilvánvaló, hogy ezek az anyagok termelődnek nagy mennyiségben.
Mivel a magasabb szénatomszámú telítetlen karbonsavak van a legnagyobb értéke S17N33SOON olajsav, vagy (CH2) 7SOON. Ez maslopodob Nye folyadék íztelen és szagtalan. Széles körű használata a technika sói.
A legegyszerűbb képviselője a dikarbonsav jelentése oxálsav (etán-dikarbonsav) HOOC-COOH, sókat, amelyeket megtalálható számos növény, mint például a sóska és a sóska. Az oxálsav - egy színtelen, kristályos anyag, jól oldódik vízben. Ezt alkalmazzák a polírozás fém, fa, vagy a bőripar.
1. Telítetlen S17N33SOON elaidinsav, transz-izomer az olajsav. Tedd a szerkezeti képlet az anyag.
2. Készítsen hidrogénezési reakcióegyenlet olajsav. Melyek a reakció termékét.
3. Készítsen egy égési reakció egyenlet sztearinsav. Mennyi oxigén és a levegő (n. Y.) szükséges elégetéséhez 568 g sztearinsavat?
4. A keveréket a szilárd zsírsavak - sztearinsav és palmitinsav - úgynevezett sztearint (nevezetesen az abból gyártott sztearin gyertyák).
Mi levegő térfogata (n. Y.) égéshez szükséges uncia sztearint gyertya, ha sztearint tartalmaz egyenlő tömegek a palmitinsav és sztearinsav? Milyen mennyiségű szén-dioxidot (pl. In.), És a tömege során keletkező vizet ebben?
5. Problémák az előző problémát, feltéve, hogy a gyertya tartalmaz egyenlő mennyiségben (azonos számú mól) sztearinsav és palmitinsav.
6. eltávolításához rozsda foltok oldatával kezeljük ecetsav. Tedd a molekuláris és ionos egyenletei fellépő ugyanakkor, tekintettel arra, hogy a rozsda és a oxidot tartalmaz vas-hidroxid (III) - Fe2O3 és Fe (OH) 3.
Miért ilyen jeleket lehet távolítani vízzel? Miért tűnik el a savas oldat kezelés?
7. nélkül hozzáadott élesztőt sütőipari tésztát (ivás) szóda MaNS03 pre „befagyasztjuk” ecetsav. Tedd haza ezt a reakciót, és ez az egyenlet, tudva, hogy a szénsav, ecetsav gyengébb. Magyarázza a habképződést.
8. Annak ismeretében, hogy a klór több elektronegatív, mint a szén. helyezze az alábbi savak: ecetsav, propionil-kéz, klórecetsav, diklór-és triklór-ecetsav érdekében erősítés savas tulajdonságokkal. Indokolja az eredmény.
9. Hogyan tudjuk megmagyarázni, hogy a hangyasav reagál „ezüst tükör”? Tedd egyenlete ez a reakció. Amely képes a gázt ugyanabban az időben?
10. képletű 3 g egybázisú karbo-korlátozó új savat feleslegben magnézium különítettek 560 ml (n. Y.) hidrogén. Határozza savat formula.
11. így a reakció egyenletet, amely leírására kémiai tulajdonságai ecetsav. Melyek Ezen reakciók termékeit.
12. Ajánlat egy egyszerű Lab módszert, amellyel felismerni propán és akrilsav.
13. Gyártmány reakcióegyenletét előállítására metil-formiát - észter metanol és a hangyasav. Milyen feltételek mellett kell a reakció?
14. Gyártmány szerkezeti képleteit anyagok, amelynek összetétele S3N602. Melyik osztályokba tartozó anyagok tudható? Így a reakció egyenletet, a jellemző mindegyik.
15. Egy anyag - izomer ecetsav - vízben nem oldódik, de lehet alávetni hidrolízissel. Mi a vegyület szerkezetét A? Mik a hidrolízis termékei.
16. Gyártmány szerkezeti képletét a következő anyagok: a) metilcsoport; b) oxálsav;
c) hangyasav; g) diklór-ecetsav; d) magnézium-acetát; e) etil-acetát; w) etil-formiát; h) akrilsav.
17 *. Minta korlátozása egybázisú szerves savval tömegű 3,7 g-oldattal semlegesítjük, vizes nátrium-hidrogén-karbonát. Átadásával a fejlődő gáz a mész vízben nyerték 5,0 g csapadékot kapunk. Mi a sav vették, és milyen gáz térfogatát megjelent?