A kísérleti izotermák - studopediya
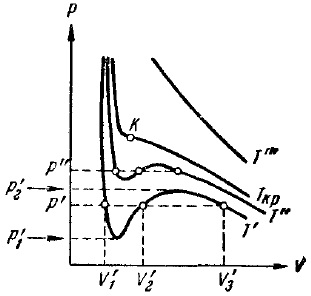
9. ábra. Izotermák van der Waals
Ábra. A 9. ábra a izotermák van der Waals-erők különböző hőmérsékleteken. Amikor a hőmérséklet a T „idavleniyah belül p'1 a P2 együtthatók (32) oly módon, hogy mind a három egyenletek valós megoldásokat; más nyomás lesz egyetlen igazi megoldás. A különbség a három valós egyenlet megoldásai csökken, ahogy a hőmérséklet emelkedik (vö izotermák T „, és T„és a T »> T«.). Mivel egy bizonyos, minden egyes anyag esetében az a hőmérséklet Tcr bármilyen nyomáson csak egy igazi megoldás az egyenlet (32). Ez az úgynevezett kritikus hőmérséklet Tcr. Ha növeli a hőmérsékletet, a megfelelő pontot a egyenlet megoldásai V'1. V'2 és V'3 egyre konvergáló, összevonása a kritikus hőmérséklet egy ábrán feltüntetett. 9 levél K. K hívják a kritikus pont. A megfelelő izoterma K egy inflexiós pont. Her mérkőzés három illő valós egyenlet megoldásai (32). Az érintő a kritikus izoterm K pontot az a határ, amely hajlamos szekáns p”, p„és m. G. Ahogy a hőmérséklet megközelíti a kritikus értéket. Ezért ezt a tangens, mint az összes secants tengelyével párhuzamos V, a származék a ponton K nulla. Ezen túlmenően, az inflexiós pont nullának kell lennie második deriváltja.
Annak érdekében, hogy izoterm kísérletileg, szükséges, hogy az ügyet a gáz halmazállapotú, tedd egy tartályban egy mozgatható dugattyú (ábra. 10), és lassan indul tömöríteni, így szimultán mért nyomás és térfogat, valamint annak biztosítása, hogy az az anyag hőmérsékletének állandó maradt . A ilyen kísérletek eredményei, hogy a kritikus hőmérséklet alatt, ábrán megadtuk. 11. Először, csökkenő mennyiségű gáz nyomása növekszik, a stroke az izoterma elég jól le Van der Waals erők. Azonban, kezdve egy bizonyos értéket Vz térfogata. kísérleti izoterma megszűnik, hogy kövesse a (31) egyenletben. Kezdve ez az érték, a kötet, a nyomás az edényben már nem változik, maga az anyag így megszűnik a homogén: része a gáz folyadékká kondenzálódik. Ez történik, mint mondják, egy köteg anyag két szakaszból áll: a folyékony és gáz halmazállapotú. Ahogy további csökkentésével egyre több és több az anyag a folyékony fázisban, ahol az átmeneti zajlik állandó nyomáson, ábrán jelzett rn.p.
10. ábra. Készülék megszerzése kísérleti izotermák
Miután az anyag kondenzációs folyamat véget ér a folyadékot (ez történik, amikor a térfogata Vl), további térfogat csökkentése kezdődik kíséri gyors nyomásnövekedés. Ebben az esetben a tanfolyam izotermák felett körülbelül a következő egyenlet (31). Az anyag az Államokban megfelelő az a része, izoterma, ismét lesz egységes, de nem egy gáz, mint egy folyadék.
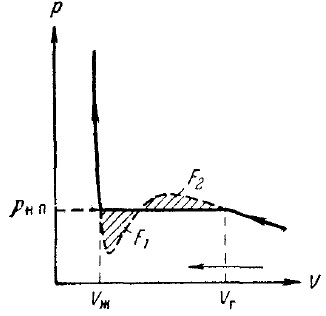
11. ábra. Izoterma igazi gáz
Így, az egyenlet a van der Waals leírja nem csak a gáz halmazállapotú egy anyag, hanem magában foglal egy eljárást átmenet a folyékony állapotban, és a folyékony préselési folyamatot.
Összehasonlítása a kísérleti izoterma izoterma Van der Waals rendelkezik, hogy ezek a izotermák egybeesnek elég jól olyan területeken, amelyek megfelelnek az egyfázisú halmazállapot, de nagyon eltérően viselkednek a szétválasztás két fázisban. Ahelyett, hogy az S-alakú curl izotermát a Van der Waals kísérleti izoterma ezen a területen van a vízszintes egyenes vonalú részt, amely úgy van elrendezve, hogy az a terület, amelyre a curl F1 és F2 (ábra. 10) azonos.
Az államok megfelelő horizontális szakasz izotermák megfigyelt közötti egyensúly a folyékony és gáznemű fázisok az anyag. Gáz (vagy gőz) egyensúlyban van a folyékony telített gőznek hívják. RNP nyomás, amelynél egyensúlyi létezhet egy adott hőmérsékleten, az úgynevezett nyomás (vagy rugalmasság) telített gőz.
A tömegarány a folyékony és gőz kétfázisú állapotban van az arány a szegmensek, mely elválasztja a vízszintes része izoterma pont képviselő állam.
Ábra. A 12. ábra a kísérleti izotermákat több hőmérsékleten. Amint látható pisunka hőmérséklet növelésével izoterma vízszintes részét csökken, húz egy pont, a kritikus hőmérséklet Tcr. Ennek megfelelően, a redukált különbség fajlagos térfogat, és ennek következtében a sűrűsége a folyadék és gőz. A kritikus hőmérséklet, ez a különbség eltűnik teljesen. Egyidejűleg eltűnik semmilyen különbséget folyadék és gőz.
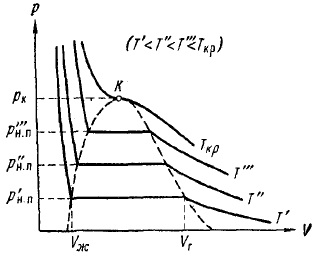
Ris.12.Eksperimentalnye izotermákat azonos gáz különböző hőmérsékleteken
Ábra. 12, hogy a gőz nyomása növekszik a hőmérséklettel, elérte a kritikus pont értéke PCR. PH függőséget. n hőmérséklet ábrán adtuk meg. 13. A görbe véget ér egy kritikus pontot, hiszen feletti hőmérsékleten a kritikus fogalmát gőz elveszíti a jelentését. Curve kezdődik egy úgynevezett hármas pontban Tr. A görbe látható. 13 jelenti a pontok helye (nyomás és hőmérséklet), amely egyensúlyban vannak, a folyékony és gáznemű fázisok. A hármas pont - Az egyensúlyi pont a három fázis: szilárd, folyékony és gáz halmazállapotú.
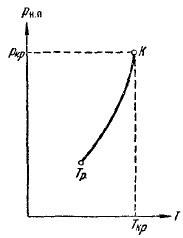
Ábra. 13. A függését gőznyomás hőmérséklet
Ha húz egy vonalat a végpontok a vízszintes szakaszok izotermák (12.), Akkor fordul a haranggörbe határoló régióját kétfázisú halmazállapot. Fölötti hőmérsékleten a kritikus nyomás bármely olyan anyag, hogy homogén. Ezeken a hőmérsékleteken, tömörítés nélkül nem lehet elérni cseppfolyósító szer.
A koncepció a kritikus hőmérséklet először be Mendeleev 1860 Mendeleev nevezzük abszolút hőmérséklete forráspontú folyékony és a Ras tekinteni, mint a hőmérséklet, amelynél a tapadó erő eltűnik a molekulák közötti és a folyékony fordul gőz, függetlenül a nyomás és elfoglalt térfogatával .
A harang alakú görbe rész és a kritikus izoterm, hogy fekszik a bal oldalon a K pontot, felosztják a diagramot (p, V) három régió (ábra. 14). Ferde keltetés régió jelzett homogén folyékony halmazállapot. Az haranggörbe, mint tudjuk, a terület a kétfázisú állapot, és végül, a régió hazudik a jogot a harang alakú görbe, és a felső ága a kritikus izoterma egy olyan régió homogén gáznemű halmazállapot. Az utóbbi akkor jelölje ki a részét, amely alatt fekszik a jobb oldali ág a kritikus izoterma, amelyben ez a két területen. Minden olyan állapot ebben a régióban különbözik a többi gáznemű Államok abban az értelemben, hogy az izotermikus kompresszió anyag kezdetben olyan állapotban áteső cseppfolyósítási eljárás. Anyag olyan állapotban kritikus hőmérsékletet meghaladó hőmérsékleten, nem lehet cseppfolyós semmilyen kompressziós. Az üzletág a gáznemű államok és gőz nem általánosan elfogadott.
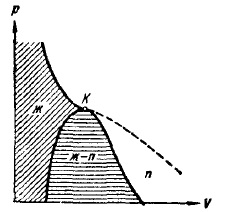
Ábra. 14. Három területei igazi gáz halmazállapotban
Kiválasztásával az átmenet úgy, hogy nem jut át a kétfázisú régióban, lehetséges, hogy az átmenet a folyadék gáz halmazállapotú (vagy fordítva), anélkül rétegszétválási anyagot két fázisra. Ebben az esetben az átmeneti anyag mindenkor azonos marad.
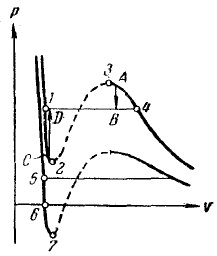
Ábra. 15. metastabil állapotok
Összehasonlítása alapján izotermák Van der Waals-erők a kísérleti izoterma azt találtuk, hogy ahelyett, hogy az S-alakú curl -3 -4 1-2 (ábra. 15) Nye kísérleti izoterma 1-4 van egy egyenes vonalú része, amely megfelel a két-fázisú halmazállapotú anyagot. Ez annak köszönhető, hogy a bizonytalanság a homogén államok megfelelő göndör 1 -2 -3-4. Az instabilitás állam területén 2 -3 nyilvánvalóvá válik, ha figyelembe vesszük, hogy ezen a területen a derivált pozitív. Ezért, egy anyag, amely képes átadni egy sorozata államok 2 -3, lenne rendelkeznie meglehetősen természetellenes tulajdonságok: megnövekedett gáz térfogata nem csökkenése kíséri, és a nyomás növelésével.
Azokon a területeken, 1-2, és 3 -4 negatív, úgy, hogy, látszólag, ezeket a területeket lehetne megvalósítani. Valóban, az államok megfelelő ezeket a szakaszokat végezhetjük ismert körülmények között. Azonban ezek nem elég stabilak: elég, például, képes a hit párban porszem, hogy az összes anyagot két szakaszra oszlik, és átvisszük a B állapotba (lásd nyíl jelzi az átmenet A -> B a 15. ábrán ..). Ezek nem elég stabil állapot, a metastabil. Az anyag az úgynevezett államokban 1-2 túlhevített folyékony anyag States 3 -4 úgynevezett túltelített gőz.