Kémiai és adszorpciós egyensúlyi
A legtöbb kémiai reakció nem megy végbe, amíg a végén. Reakciók, hogy sor kerülhet egyszerre két ellentétes irányban, az úgynevezett reverzibilis. Ha az arány az ilyen reakciók száz-csicseriborsó egyenlő,
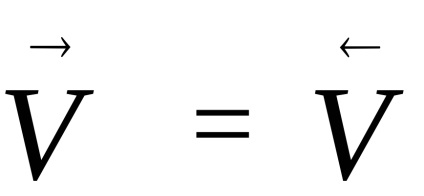
egyensúlyi állapot jellemzi, hogy milyen mértékben az adott körülmények között-TION reakciót, ha egyszer elkezdődött, továbblép spontán (ΔG <0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарно-изотермического потенциала происходить не будет (см. рис.1)
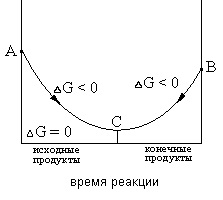
A változás ΔG 1. ábra a reakció áramlás

Homogén reverzibilis reakciót aA + BBe

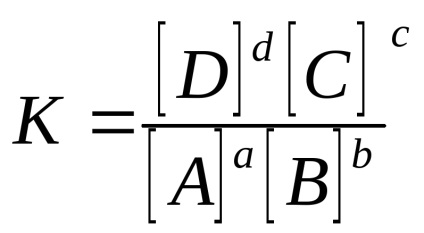
gáznál rendszerek:
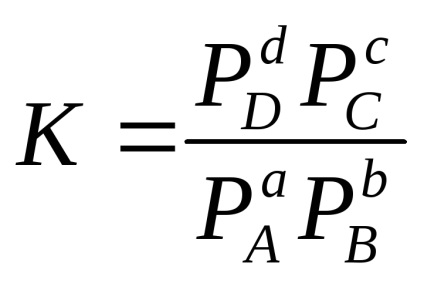
Például, a reakciót:
A jellemzője a heterogén kémiai egyensúly hiánya egyensúlyi állandók a vonatkozó tagállami a szilárd anyagokat.
Ezen a hőmérsékleten, a reakciópartnerek parciális nyomásának, a megállapítás-schihsya a kondenzált (szilárd vagy folyékony) állapotban, állandó, és nem függ a reagensek mennyisége. Ezért, ezek a parciális nyomások jellemzően egyensúlyi állandó. Így a reakció
CaCO3 (t) = CaO (ek) + CO2 (g);
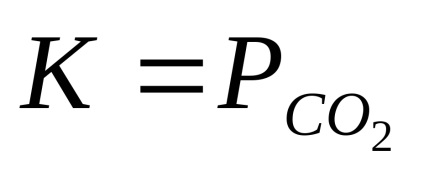
Az egyensúlyi állandó kapcsolatban van egy változás a izobár-izoterm potenciális kémiai reakció ΔG ° kapcsolatban:
Mivel ΔG ° = ΔNº - TAs °; RlnK = ΔS ° - ΔNº / T
emiatt a K = e -Δ H ° / RT e Δ S ° / R
A egyensúlyi állapotok a reverzibilis reakciót ΔG ° =? H ° - T · ΔS ° = 0 lehet számítani a hőmérséklet, amelyen egyensúly
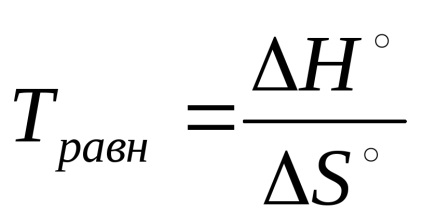
Ezekből az egyenletekből következik, hogy az egyensúlyi állandót nagyon érezte-nek a hőmérséklet változására. A hatást az egyensúlyi állandó alapján-szállítás a reagensek meghatározza a függőség a entalpia (ΔNº) és entrópia (ΔS °) tényezők.
A reaktánsok koncentrációja és a nyomás (ha ez nem túl SZEZON-valami), az egyensúlyi állandó független. Amikor a változó feltételek (hőmérséklet, nyomás-TION, koncentráció) az egyensúlyi állapot zavart.
Egyensúly eltolásával változásától függően körülmények általában a Chatelier elv: Ha a rendszer egyensúlyban van, hatással kívülről módosítaná a feltételek, amelyek meghatározzák az egyensúlyt, akkor irányában mozdul el a folyamatábra, amely gyengíti a hatást hatására képződik. Következésképpen, a hőmérséklet emelkedését eltolja az egyensúlyt felé endoterm folyamat, és csökkenése - az irányt az exoterm folyamat. Tekintettel arra, hogy a? H = -Q
RlnK = ΔS ° + Q / T (exoterm reakció).
RlnK = ΔS ° - Q / T (endoterm reakciók).
Általában, az olyan területeken, jellemző a magas hőmérsékletű endoterm reakció-paraméter, és alacsony hőmérsékleten - exoterm. Nyomás rose-shenie előfeszíti az egyensúlyi keletkezése irányába kisebb CO-lichestva gáznemű molekulák koncentrációjának növelése a kiindulási anyagok - az irányt képződésének reakciótermékek. A másik hatás egyenleg kerül kényszerült, illetve a mellékhatások Obra mations kiindulási anyagok. Például, az exoterm reakció
.
az egyensúlyi képződése irányába ammónia növelése érdekében szükség van a koncentráció elmozdulás a kiindulási anyagok (a legelőnyösebb, hogy növelje a hidrogén koncentrációját), hogy csökkentse az ammónia koncentrációja a hőmérséklet csökkentésére, vagy növelje a nyomást.
Adszorpciós - abszorpciós folyamat egyik felülete a más anyagok miatt nem kompenzált erőterek részecskék a felületi réteg (a határfelületen).
Az anyagok, amelyek nyeltek el a részecskék (gáz, folyadék, feloldjuk komponensek) nevezett az adszorbeátum és az abszorber - adszorbens.
A szemcsék közötti kölcsönhatások a adszorbeátum és az adszorbens változtatható. Jellegétől függően ez a kölcsönhatás megkülönböztetni a fizikai és kémiai adszorpció (kemiszorpció).
A fizikai adszorpciója az adszorbeátum és az adszorbens részecskék kötődnek viszonylag gyenge intermolekuláris kölcsönhatás erők (Van der Waals-erők). Egy példa a fizikai adszorpció adszorpciója gázok vagy oldott anyagok aktív szén.
A kemiszorpcióját adszorbeátum és az adszorbens részecskék kötődnek erősebb adhéziós erők miatt bekövetkező kémiai kölcsönhatások vezető kialakulását egy új anyag. Egy példa a kemiszorpciós szolgálhat egy oxigén adszorpciós fémek. A folyamat a szétválasztása részecskék adszorbeátumot a felületről a adszorbenssel, vagyis, jelenség, hogy a fordított adszorpció hívják deszorpció. Ha a rendszer „adszorbeátum - adszorbens” előre meghatározott körülmények azonos sebességgel az adszorpciós, deszorpciós sebesség, a rendszer állapotot nevezik adszorpciós egyensúly. Kemiszorpcióját végbe visszafordíthatatlan.
Mennyiségileg adszorpciója adszorbeátum kifejezve mol per egységnyi felület adszorbens (mol / m 2) vagy adszorbeátum mól egységnyi tömegű abszorbens (mol / g).
A mennyiség az adszorpciós függ természetesen az adszorbens és az adszorbátum koncentráció és a hőmérséklet (vagy nyomás) adszorbeátumot. Curve adszorpciós értéke egyensúlyi koncentrációi az adszorbeátumot vagy a p nyomás állandó hőmérsékleten T nevezik adszorpciós izoterma: T = f (c) vagy F = f (p) T = const.
A függőség adszorpciója az adszorbens koncentrációjának (T = const) expresszálódik a Langmuir egyenletet (feltételezve, hogy a felület a adszorbens homogén).
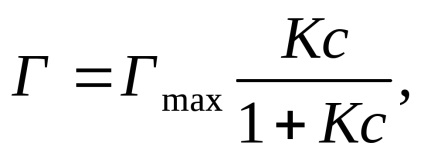
ahol T jelentése az adszorpciós összeget; Gmax - maximális adszorpciós összege okozta felülete az adszorbens; K - állandó adszorpciós egyensúlyi helyzet; c - egyensúlyi koncentrációja az adszorbens.
Adszorpció növekszik a koncentrációja vagy a nyomás az adszorbeált anyagok megfelelően adszorpciós izoterma (2. ábra, a).
Kifejező egyenlet Langmuir formájában:
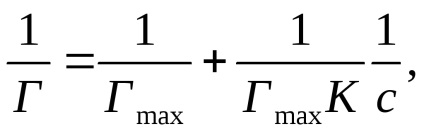
kapott lineáris függését 1 / T 1 / s (2. ábra b).
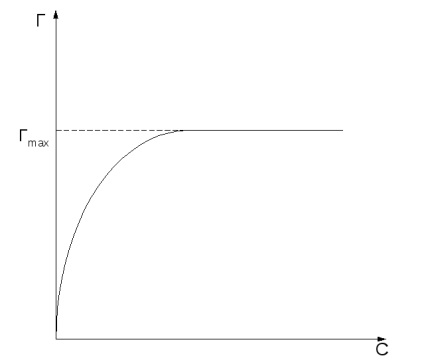
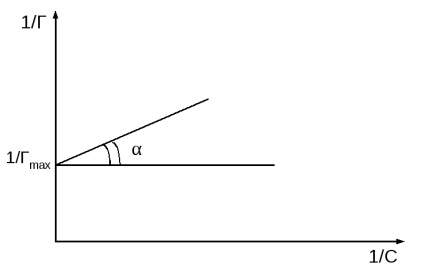
2. ábra: Langmuir izoterma két formában.
Az ordináta tengely metszéspontja 1 / Gmax. és tg = 1 / K · Gmax
A grafikon épült a koordinátákat 1 / r - 1 / s, számított abszorpciós maximum értéke (Gmax), egy ezután egyenlet Langmuir adszorpciós egyensúlyi állandó (K).
Magas koncentrációk (nyomás) értéke K · s „1
(K · p „1) Langmuir egyenletet válik F = Gmax.
Adszorpciós széles körben használják a tengeri, például a tisztítására gázok és folyadékok a különböző szennyeződések; A feldolgozás a tengeri technológia kezelésére és teljesítményének javítása kenőanyagok, a környezeti problémák megoldására a flotta, stb