Topic - 18 oxigén alcsoport
Téma - 18: alcsoport Oxygen. Allotrópia oxigén és kén. Jellemző elemeit alcsoportok oxigén. Összehasonlítása a hidrogén tulajdonságait vegyületek.
· Jellemzők atomok csoport VI.
· A tulajdonságait, összetételét, előállítását és alkalmazását a legfontosabb kémiai vegyületek.
· Jellemzésére az általános tulajdonságait nem csoportjába tartozó fémek VI.
· Összetétel Kémiai képlet hidrogénatom vegyületek, savak.
18.1. Általános jellemzők
Főcsoport VI csoport elemei képeznek Kitty lorod (O), kén (S), szelén (Se), tellúr (Te) és a polónium (Po), amelynek a csoport az úgynevezett "oxigéncsoport", ami azt jelenti, vperevode "rudoobrazovateli".
A szerkezet a külső elektronikus atomi réteg az al-csoport ns2np4. Ugyanez a szerkezet vegyértékei szintje meghatározza hasonlóságot kalkogén azok mindegyike ksemeystvu p-elemek nemfémek (kromepoloniya). Miután a 6 külső réteg a elektronok, atomok adatelemeket csatolt a hiányzó oktett 2 elektront, és a találmány szerinti vegyületek alacsonyabb oxidációs foka egyenlő (- 2).
Kén, szelén, tellúr és polónium és a felépítmény-képző vegyület Alikhan'yan és munkatársai, amelyben kifejtett pozitív-WIDE oxidációt.
Electron grafikai képletű kalkogén atomok a fő (energiamentes) állapotban:
A jelen két páratlan elektronnal, ami egy tipikus minden halkogenoov vegyérték egyenlő-nek a II.
Minden kalkogén atomok (eltérő oxigén) a kosár-gerjesztett állapot növelheti a számát nespa-rennyh elektronok miatt elektron átmenetet SNR - sublevels-inek svobodnyynd alréteg. Ebben az esetben, a következő vegyértékétől atomok:
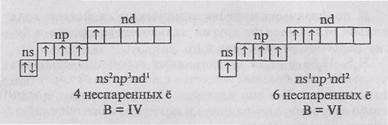
Mivel a vegyértéke az oxigénatom van elekt-tróna második szint, amelynek nincs d-alréteget, az oxigén atomok a gerjesztett állapotban átmenet a nem-lehetséges. Ezért az oxigén állandó vegyértéke-ness P.
Kén, szelén és tellúr oxigénnel a vegyületek pro-+4 oxidációs állapotban van, és a +6. Ezek az elemek képeznek Obra-típusú oxidok EO2 és EO3 amelyek savas jellegű. A megfelelő hidroxidokból van Kitty tételek. Erősségek közé csak a kénsav és a szelén, mások nagyon gyenge. A növekvő oxidációs fok növekszik, és a savas és oxidáló tulajdonságai hidroxi-sorok és a megfelelő savak.
A oxigéncsoport és hidrogén vegyületek mutatnak minden-egyenértékűségét egyenlő II (oxidációs állapotának -2).
H2S, H2Se és N2Te képviseli a hagyományos körülmények között a gáz-halmazállapotú anyagok kellemetlen illat jelleget NYM. Mindegyikük mérgező. Amikor vízben oldjuk, gyengén disszociált, és ezért gyenge savak MI. A disszociációs mértéke megnövekszik enyhén való átmenet során a H2S-nek N2Te. Ugyanabban az irányban csökken tartósságát a molekulák (melegítés és H2Se N2Te bomlik).
Összes vegyület a szelén és a tellúr mérgező.
Összehasonlítása a fő elemei a alcsoportok VI. és VII csoportok, valamint ezek vegyületei vezet az alábbi következtetéseket:
1. kalkogén fémes tulajdonságok vannak kifejezve HN gyengébb, mint a halogén.
2. Oxigén kalkogén vegyületek (oxidok és savak) sokkal stabilabb, mit halogén-új.
3.Halkogenovodorody (a vizet kivéve) kevésbé poláros és kevésbé erős, mint a hidrogén-halogenidek.
4. A részhalmazának a különbség a kalkogén elem-ter még kifejezettebb, mint abban az alcsoportjában a halogén-új.
A legfontosabb a fő alcsoportban VI társulat az oxigén- és kénatom, valamint ezek vegyületei.
18.2 Oxigén és vegyületei
Az oxigénmentes állapotban létezik két allotropic módosításokkal: O2 - oxigén és O3 - ózon.
O2 oxigén normál körülmények között - a gáz színtelen és szagtalan; T = -183 ° C; kissé nehezebb, mint a levegő, tutaj-ség 1.43. Vízben kismértékben oldódik: 1 L a n. y. RA-stvoryaetsya = 0,07 g. Folyékony oxigén - egy mobil, enyhén kékes folyadék.
Az ózon O3 normál körülmények között - a gáz kék, a szúrós szagú; Forráspont = -112 ° C-on A vízben való oldhatósága nagyobb, mint az oxigén. Folyékony ózon -szubsz-tancia sötétkék, majdnem fekete. Robbanásveszélyes minden államban az összesítés, mivel spontán bomlik Xia a megjelenése nagy mennyiségű energiát.
18.2.1 előállítása szabad oxigén
Nagyon tiszta oxigén lebontása útján elektrolit-ügynökség víz jelenlétében elektrolit (for-például, W „”
A laboratóriumi körülmények között, az oxigén, úgy állíthatjuk elő lebontó hevítve instabil CPD-Neny oxigént tartalmazó összetételében, például:

Az ózon képződik a felső atmoszférában (magasságokban-cho mintegy 50 km) a szabad oxigén. Hatása alatt ultraibolya sugárzás oxigénmolekulák dis-sotsiiruyut előállítására atomos oxigén:
18.2.2. Kémiailag tulajdonságai oxigén
A reakcióban az O2 egyszerű anyagokkal - Me-tallium és nemfémek - általában képeznek oxidokat, például:
Vannak azonban kivételek. Például, ha az oxigén lenii-oxidok az alkálifémek, például nátrium és kálium, formája elsősorban peroxidok (a-c LED yavlyayutsyapobochnym termék):
Szinte az összes reakciót, amely O2 exoterm, néhány kivétellel:
A jellemző sok reakciót párosul oxigén-ció izolálását a hő és fény. Az ilyen reakciókat nevezzük égés.
Számos komplex vegyületek is oxidálódik savanyú született. A kölcsönhatás O2 hidrogén-csatlakoztatott niyami nemfémes víz képződik, és a nem-egyéni out etsya legyen az szabad állapotban vagy alakjában alkalmazás-Sid, attól függően, hogy a reakciókörülmények:
Hatása alatt alacsonyabb oxigén-oxidok és -hidroxidok a megfelelő vegyületet egy meg-sokoy oxidációs:
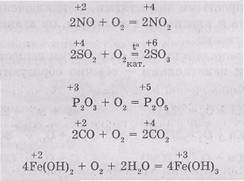
Az oxigén égett majdnem az összes szerves
anyagokat. teljes oxidáció termékek fejek NYM módon, szén-dioxid és víz.
18.2.3. hidrogén-peroxid
Színtelen folyadék volt, amelynek olvadáspontja -0,41ºS és forráspont = 150, 2 ° C-on és sűrűsége 1,45 g / cm3. Tiszta hidrogén-peroxid robbanásveszélyes.
Ezután a hidrogén-peroxid savas, köszönhetően annak molekuláris disszociációja a gyenge sav típusa:
Néhány fém-peroxidok, például a Na2O2, BaO2, lehet tekinteni, mint gyenge savak sói peroxi és hidrogén. Tőlük lehet kapni a hatása H2O2-bo Lee erős savak:
Peroxidok jellemzi a jelenléte a molekulák a lánc peroxidos oxigénatomot tartalmaz;
18.3.1. Kén és vegyületei
kén relatív elektronegativitási sokkal alacsonyabb, mint az oxigén, így összehasonlítva, oxidok, kén-gyulladásos képessége jelentősen meggyengült, Lena.
Mindazonáltal, a kén képez stabil vegyületet hidrogén és egy fém, amely oxidációs állapotban -2, De, ellentétben az oxigén, kén susche-létezik vegyületek pozitív oxidációs állapotú. A legfontosabb vegyületek, melyekben a kén különböző oxidációs állapotok a következők:
szabad kén 18.3.2Allotropiya
Egy egyszerű anyag a kén egy nagy számú allotropic módosítások eltérő közötti CO-harci készítmény és molekuláris szerkezete. A atomok száma egy mól-kulah különböző allotropes kén változik széles com - 3-20; molekulák egy CEC-ciklikusan és lineáris szerkezetű.
Normális körülmények között, a kén létezik egy gyémánt-cal módosítását. A molekulák tartalmaznak 8 kénatomot egymáshoz egyes kovalens kötések egy zárt ciklusban.
Rombusz kén -, kristályos, szilárd anyag formájában vesche-TION sárga, csaknem oldhatatlan vízben, de jól oldódik szén-diszulfid CS2 és az aceton.
Feletti hőmérsékleten 95 ° C-on rombusz kén előre forgatjuk a monoklin módosítás: Az olvadt ként tartalmaznak szinte minden allotropes.
A laboratóriumi körülmények között, szabad kén lehet ebben luchit annak vegyületek oxidációjával-Boc-stanovitelnyh reakciókban, így például:
18.3.3. Kémiai tulajdonságok kén
Kén - reaktív nonmetal. Ismert vegyületei, szinte minden eleme eltérő inert gázok, arany és platina fémeket.
Amikor kölcsönhatásban egyszerű anyagok képező en-elemek egy kisebb EO, mutat a kén-oxidok - gyulladásos tulajdonságok: S0 + 2G → S2-
Amikor kölcsönhatásban egyszerű anyagok képező en-elemek nagyobb EO, kén mutat Sun-stanovitelnye tulajdonságok:
Így a kén égő levegőben kékes láng, így képződött kén-dioxid:
A fluor kén meggyullad még normál párologtató-D a kialakulását a kén-hexafluorid:
S + 3f2 → SF6
A klór- és brómatom reagáltatjuk kén enyhe melegítéssel alkotnak halogenidek, például:
S + Cl2 → SCl2
A vizes oldatok a lúgokkal melegítés alatt kén-elutasítják autoxidációs - gyógyítani (diszproporcionált):
Hidrogén-szulfid H2S - színtelen, toxikus gáz erősen kellemetlen szagú; Op = -. 85 ° C-on, és bp = -60 ° C-on Ra-eltömődésének vizes ble H2S vízben alacsony (szobahőmérsékleten séklet egy kötetben vízben feloldunk 2,5 H2S térfogat).
A természetben, hidrogén-szulfid képződik nagy audio kimenet MEGFELELŐEN miatt biokémiai folyamatok.
Baktériumok termelnek H2S a Wood közülük organizmusok a Földön. A hidrogén-szulfidot is megtalálható vulkanikus gázok és a víz ásványi források.
Az iparban és a laboratóriumi félig szulfid chayut hatása erős savak fém-szulfidok.
Ahogy kétbázisú, hydrosulphuric sav Obra-zuet két sorozat sók - szulfidok és hidroszulfidok. Ellentétben a legtöbb szulfidok hidroszulfidok ho Rosho oldódnak vízben.
Szulfidok és hidroszulfidok kisebb mértékben a víz-CIÓ oldatot hidrolízisnek vetjük alá, ahogy ob razovany gyenge sav. Például:
kemping be oxidok, néha szulfátok, és néha bocsátanak ki annak Bodnya-fém.
Néhány szulfidok egy változó összetételű. Po
lisulfidy, például vas (II) képez több
szulfidok, amelyek közül a legfontosabb FeS (szulfid
vas) és FeS2 (vas-diszulfid). Ennek az az oka, hogy a
hogy a kénatomok a szulfid készítmény képezhet
közötti kovalens kötés (úgynevezett „szulfid hidak”). Grafikus képletű FeS2 a következőképpen:
A nátrium-poliszulfidok ismert variábilis redőny akár Na2S2 Na2S5. Amikor a sárga oldatot poli-szulfid túlfeszültség sósavval, van egy félig mnogosernistyh bomlása fém alkotnak H2S-em és S.
18.3.5. kén-oxidok
Kén oxigénnel formák több oxidok, de csak két stabil: SO2 - kén-oxid (IV) és SO3 - a kén-oxid (VI). A találmány szerinti vegyületek tulajdonságait-ny vannak hasonlóságok és különbségek.
Mivel tipikusan nem-fém-oxidok, mindkettő Kitty lotny természetét, egy sokkal kifejezettebb SO3. Azonban, különböző oxidációs fokú a kénatom az SO2 és SO3 okoz lényeges különbség az oxidációs-redukciós szer-CIÓ E vegyületek tulajdonságai.
Kiállító kémiai tulajdonságok tipikus savas oxidok, kén és kén-trioxid oldott Interaction:
a) bázisokkal, alkotó kétféle sók: és savas közegben.
SO2 + NaOH → NaHSO 3 Nátrium-hidrogén-szulfit
SO3 + NaOH → NaHSO 4-nátrium-hidrogén-szulfát
b) az alapvető oxidok
SO2 + CaO → CaSO3 kalcium-szulfit
SO3 + CaO → CaSO 4 kalcium-szulfát
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Kén-dioxid. A molekulák SO2 kénatomot van egy közbenső oxidációs állapotban (+4), így a kén-dioxid kombájnok és oxidáló és redukáló képessége, az utóbbi pre-