myostatin blokkolók

Blokkolók gátolják a miosztatin Myostatin-specifikus fehérje szabályozásáért felelős és korlátozása izomnövekedés. Ez vezet az a tény, hogy az izmok lesz „pumpált”, mintha a sportoló továbbra minden nap megy a tornaterem, de valójában már rég nem a foglalkoztatás.
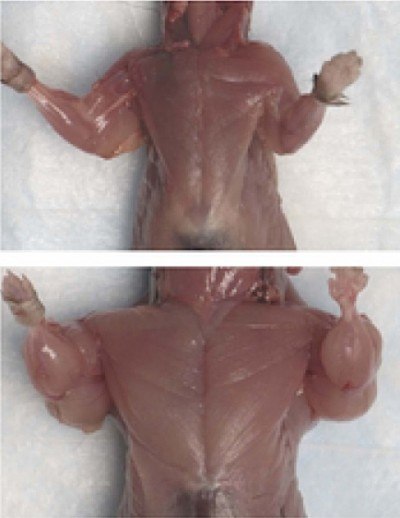
Az utóbbi évtizedekben a keresést helyreállítása utak és izomtömeg növekedésével nem csak a kis molekulájú antikatabolikus és anabolikus szerek, az NN, hanem keresni a gén felelős szint a homeosztázis az izomszövet. Az objektum felismerni az ilyen géneket volt különösen húsmarha fajta a fenotípus egy úgynevezett kettős izom (tenyészteni kék belga és piemonti)
Fajta kék belga bika. Együtt jelentős növekedése minden izomcsoport látható a szinte teljes hiánya a bőr alatti zsírszövetben.


Ennek eredményeként ezek a kísérletek során bebizonyosodott, hogy a fehérje GDF-8 negatív szabályozója a vázizomzat növekedését. Így nevezte myostatin. és az állatok az ilyen hiba - myostatin nulla egér.
Az a képesség, hogy korlátozzák a miosztatin izmok növekedését azonnal felkeltette a figyelmét, mint potenciális terápiás beavatkozási degeneratív betegségek, a trauma és más betegségek a mozgásszervi rendszer, valamint - az alkalmazásra sportorvos és a sport.
Azt találtuk, hogy annak szerkezetét myostatin tárgyát olyan fehérjék, mint például a TGF-béta (transzformáló növekedési faktor-béta, transformiruyushy növekedési faktor-béta), amelyek szekretált faktorok szükség, mind az embriogenezis során és a felnőtt szöveti homeosztázis.
Myostatin van közös szerkezeti elemeket, más fehérjékkel TGF-béta család:
hidrofób magot a régióban N-terminális része a molekula, amely arra szolgál, szekréciós szignált;
konzervatív blokk négy aminosav a C-terminális felét a molekula, amely egy jelet feldolgozó (proteolitikus hasítással képződését aktív fehérje egy prekurzora nagyobb hosszúság);
kilenc ciszteinek a C-terminális része a molekula kialakításához szükséges egy funkcionálisan aktív szekunder struktúrát. A feldolgozás után a C-terminális domén, ami válik funkcionálisan aktív miosztatinnak. Ez marad nem kovalensen kapcsolódó N-terminális része a molekula, amely ebben az esetben az úgynevezett propeptid;
myostatin. valamint más fehérjék típusú TGF-béta, szekretálódik inaktív komplexet a propeptidet.
A folyamat a miosztatin expresszió. esetleg szabályozott fehérje Titin-cap, azt találtuk, hogy szintézise ez a fehérje csökkenti a miosztatin hozamát sejtek. A szekretált, mint komplex a propeptid miosztatin aktivitást, mivel nem képes kötődni a receptorához. Észlelni miosztatin aktivitást kell különíteni a propeptidet. Az aktiválás végezzük miosztatin propeptid hasítási típusú proteázok katepszin D.
Úgy gondoljuk, hogy a legtöbb szintetizált miosztatin fejti ki hatását, autokrin és parakrin módon, azaz a. E. Myostatin jár belül a sejtek szintetizálják és a közvetlen környezetében. De a legújabb kísérletek igazolták a lehetőséget endokrin megnyilvánulása tevékenységét, a t. E., szisztémás expozíció helyileg szintetizált myostatin minden izomcsoportot.
A megnyilvánulás tettének miosztatin kell vennie a kapcsolatot a neki megfelelő receptor. Kimutatták, hogy a miosztatin kölcsönhatásba lép aktivin receptorszerű ActRlIB. Egerek megváltozott receptor ActRlIB, ha nem tudja továbbítani myostatin kötési jelet a sejt belsejébe, is mutatnak megnövekedett izom, mint a nulla-Myostatin egér.
A embriogenezis, myostatin génexpresszió kezdődik miogén progenitor sejtvonal és kiterjeszti a felnőttek és paraxiális axiális izmok. A szint miosztatin szintézis különbözik a különböző vázizom.
Későbbi kutatás megállapította expresszióját a miosztatin gén más szövetekben. Kimutatták, hogy a miosztatin van szívizomsejtek és Purkinje-rostokban a szívben, miosztatin mRNS szintézis megtalálható a emlőmirigyek és adipocitákat.
Feltételezhetjük, hogy nemi különbségek összege kiválasztott myostatin. valamint más tényezők, amelyek befolyásolják a szexuális dimorfizmus a fejlesztés vázizmok. Az azonos szintű miosztatin mRNS szintézist. t. e. miosztatin gén expressziós szintje, szintje szekretált miosztatin magasabb a nők, mint a férfiak.

Mivel a kezdetektől embriogenezis miosztatin gén kifejeződése folytatódik a szülés utáni izmok és az izmok a felnőtt szervezet, a miosztatin. Úgy tűnik, hogy jelentős szerepet játszanak valamennyi szakaszában izomképződés szöveti homeosztázis és a vázizom felnőtt hatása alatt különböző funkcionális ösztönzőket, többek immobilizáció.
Aktiválás és Myf5 MyoD gén ad okot, hogy a miogén sejtvonal, progenitor sejtek (progenitor sejtek) nem kelthet mioblasztok. Aktiválás myogenin gén stimulálja mioblasztokat osztani (proliferáció) és az azt követő differenciálódás. Myostatin. aktiválja a p21 gén, és a fehérjék szintézisét Smad-határértékek (vagy leáll) proliferációját mioblasztok. Myoblastokon beszüntették részlege, formaképződés lépéssel folytatódik, vagyis a lap prekurzorok izomrostok - .. izomcsövek. Kölcsönhatásban áll egymással, úgy vannak elrendezve a láncot, és beleolvadnak a hosszúkás sokmagvú sejtek (syncytia). Fúzió után a membránok kezdődik differenciálódás, biokémiai és citoplazmatikus differenciálódását, és ezáltal a végső formázott érett izomrostok.
Érett izomrostok a terminális differenciálódás termék, m. E. Sem ők, mint a szerkezet egészének vagy sejtmagok a szálak nem lehet osztani, és az izom növekedés és regeneráció keresztül valósul meg npoliferatsii műholdas sejt. Műholdas sejtek méretei közel a méretei a sejtmagok az izomrostok és, mivel ezek a magok vannak a kerületén az izomrostok. Csak elektronmikroszkóppal hagyjuk annak megállapítását, hogy fizikailag elkülönítik az érett izomrostok és között található a szarkolemma és a bazális membrán.
A izomrostok száma citoplazma kapcsolatos egy egymagos, megtalálható bizonyos meglehetősen szűk tartományban (CASE-nukleáris rendszer tartomány). Megnövelt szálak mérete (hypertrophia) érjük összevonásával műholdas szaporodó sejtek a szál úgy, hogy mionuklearnogo domén méretek ugyanabban a tartományban, mint korábban hipertrófia. A lendület a körzet (proliferáció) a szatellit sejtek a felnőtt szervezetben elsősorban trauma, beleértve szintjén az egyes izomrostok. Coming ki nyugalmi, műholdas sejtek elkezdenek kifejezni miogén markerek, t. E. Az aktivált gének specifikus mioblasztok. A regenerálás során sérült szatellit sejtek vázizom egyesült meglévő izomrostok (hipertrófia), vagy egymás között, új szálak (hyperplasia).
By arányának meghatározásakor a szatellit sejtek izomszövet, ez sokkal kényelmesebb összehasonlítani miofibrillumok és műholdas sejtek száma atommagok, mert sokmagvú izomrostok. A felnőtt állapotot nucleus szatellit sejtek alkotják 2-7% -a az összes sejtmag különböző izmokat. Születéskor műholdas sejtmagba, hogy mintegy 30% -a az összes atommagok az alsó végtag izmai. Ezek újszülött műholdas sejtek szaporodnak és fuzionálni izomrostok növekszik, így nekik további mag postnatalis vázizomzat növekedését.
Válaszul miotravmu szatellit sejtek aktiválódnak és szaporodik. Része a sejtek a felosztás után visszatért a nyugalmi állapot (helyreállítása műholdas sejt állomány). A legfontosabb része a sejtek eredményeként kemotaxis vándorolnak a károsodott területek és mértékétől függően a sérülés vagy egyesül egy sérült izomrost vagy szatellit sejtek egymásba olvad képező új szál. Kernel nemrég egyesített cella a műhold a közepén a szál. Mivel a helyreállítási sejten belüli struktúrák rost vándorolnak a periférián.
Így, műholdas cellák segítségével fenntartása funkcionális állapota a vázizom a felnőtt szervezet. Úgy van szükség, hogy javítja a sérült izomrostok és a forrása a magok izom hipertrófia eredményeként képzéseket. Hipertrófia és (vagy) hyperplasia vázizom állatokban hiánya funkcionálisan aktív myostatin azt bizonyítja, hogy a miosztatin hatással elterjedése szatellit sejtek, mert a szülés utáni izomnövekedést és számának növekedése a magok izomrostok fejlesztés során a felnőttkorig miatt előfordul, hogy elterjedése szatellit sejtek .
Amikor aktiválódik, a műholdas sejtek (hozam nyugalmi) elkezdenek dolgozni gének specifikus myoblastokon, és így, a műholdas sejtek mioblasztok. A mértéke proliferáció műholdas sejtek felnőtt izom miosztatin is korlátozott, mivel a proliferációját mioblasztok az embriogenezis. Kimutatták, hogy a fehérje a TGF-béta gátolja a sejtek szaporodását a tenyészetben a műhold.
Szerepe a homeosztázis érett miosztatin izomrostok, amíg teljesen tisztázott, de van számos tanulmány a szintézisét két mRNS szintje a miosztatin. és a miosztatin az izomban a felnőtt állatmodellekben és emberekben alapján különböző fiziológiás körülmények között.
Így, szisztémás túlexpressziója miosztatin egerekben két hétig elvesztését eredményezi a több mint 30% a teljes testsúly és az izom tömege 50%, m. E. Kép gyakorlatilag azonos cachexia szindrómát emberekben. Megállapítást nyert, hogy a miosztatin járhat endokrin módon. Bevezetés myostatin propeptid vagy follisztatin inhibitorok lelassítja a izomtömeg-veszteséget a megnövekedett szinten miosztatin.
Azt is fontos megjegyezni, hogy amellett, hogy az izomtömeg szinte teljes elvesztése bőr alatti zsír, ami szintén összhangban van az adatok hatására a miosztatin a differenciálódás a zsírsejtek.

Intramuszkuláris és szérumkoncentrációja miosztatin emelkedik AIDS-es betegeknél a szakaszban, ahol az izomtömeg. A koncentráció miosztatin fordítottan arányos testtömeg-index tiszta. Ezek az eredmények azt mutatják, hogy a miosztatin hozzájárul izomsorvadás AIDS-ben, valamint, hogy a miosztatin blokkolók hasznosak lehetnek a gyógyászatban.
A közvetlen kísérleteket patkányokon mutatták, hogy az izomtömeg-veszteséget fordul elő, hogy űrrepülés során, amely nagyobb miosztatin szintje vázizomzat (2-5-szeres a különböző izmok a 17. napon a repülés). Ezek az eredmények azt mutatják, hogy a miosztatin egyik fő eleme a multifaktoriális kórélettan előforduló űrrepülés izomsorvadás.
A földi kutatás, amely az emberi alanyok úgy találta, hogy a 25. napon az álló módot (például űrrepülést modell) szintje miosztatin emelkedik 12% -kal.
Az immobilizálást izom egerekben megnöveli koncentrációjú miosztatin mRNS (myostatin génexpresszió) immobilizált izmok után 24 órával a kísérlet, bár a izomtömeg veszteség csak kezdődik a harmadik nap után. A legmeglepőbb eredmény e kísérleteknél kapott volt, hogy myostatin szignifikánsan különbözött szintézisét illetve az izmokban tartalmazó különböző izoformákat (változatai) a nehéz lánc a miozin. Amikor immobilizáció myostatin szintézis jelentősen nőtt bystrosokraschayuschihsya izomrostok sorvadt, hogy a hetedik napon 17%, míg a m. soleus, ahol a miosztatin szintézis nem érzékeli, amellett, sorvadt napon 42%. M. soleus az csak I. típusú szálak és Pa, míg m. gastrocnemius és m. plantaris képviseli típusú IId / x és II, bár tartalmaznak I. típusú és a At. Az egyetlen elfogadható magyarázat erre a jelenségre - hatása a miosztatin szintetizált m. lábikraizmot és m. plantaris, a m. soleus, t. e. endokrin hatások.
Egy másik magyarázat, hogy a miosztatin szintézis korrelációban van a szálak típusa, azaz. E. szintézise miosztatinnak a immobilizálását izmok egerekben korrelál a nehéz lánc izoformája miozin IIb.
A modellben a Duchenne-izomsorvadás (mdx egér vonal) azt mutatja, hogy myostatin blokkolók (antitestek intraperitoneális injekcióval myostatin) három hónapig vezet megnövekedett izomtömeg, az izom nagyságát és erejét. A hibridek egerek myostatin nulla mdx egerek lényegesen jobb állapotban izmokat, mint az eredeti egér mdx vonalon. Normalizálás egerek izom állapot mdx vonal vagy blokkolásával myostatin Myostatin-nullátmenet egereken új lehetőségeket nyit a patológiás állapotok kezelésére járó izomtömeg-veszteséget.
Több mint negyven éve azt javasolták létezését szövet-specifikus inhibitorok - chalones (chalones), szintetizáló ez a szövet, gátolják a növekedést, és így fenntartani a megfelelő tömege ennek a szövet. Ezt a feltételezést később megerősítette abban az esetben vázizmok.
Forrás: Sport farmakológia (Seyfulla)
