Fehérjék, mint a kolloidok
Minden állati és növényi szövetekben állnak különböző kémiai vegyületek: fehérjék, szénhidrátok, zsírok és vitaminok. Bár ezek az anyagok szükségesek a normális fejlődését a test, a legfontosabb fehérjék. Ezek szolgálnak az alapvető kérdés, amelynek minden egyes sejtek és az egész szervezetre. A fehérjék legmagasabb foka fejlesztésének kérdése, és velük együtt az összes elválaszthatatlanok számtalan különböző megnyilvánulásai az élet, kezdve a legegyszerűbb funkciója a legprimitívebb lények bonyolult emberi tevékenység funkciókat.
a fehérje szerkezetének. Vannak egyszerű és összetett fehérjék. Egyszerű fehérje jelenleg úgy, mint a termék a polikondenzációs aminosavak, t. E. A természetes polimer. Komplex fehérjék állhat egyetlen fehérje és nem-fehérje komponensek - szénhidrátok, lipidek, nukleinsavak és más vegyületek.
Gyakori, hogy az összes fehérje az, hogy a makromolekulák áll a sok száz egység egymással úgynevezett peptid kötés, amelynek szerkezete
Természetüknél fogva, minden link - a többi az egyik aminosav. Alkotnak polipeptid lánc, amelyek mindegyike tartalmaz több tíz vagy akár több száz különböző aminosavak. Minden más aminosavakat alkotó fehérje # 945-aminosavat jelent, amelyben az aminocsoport NH2 kapcsolódik ugyanahhoz a szénatomhoz kapcsolódik, amely kapcsolódik, és a karboxil-csoport COOH. Minden a-aminosav-(kivéve a heterociklusos) kifejezhető az általános fore-muloy
ahol R - szénhidrogéncsoport.
Aminosavak különböznek egymástól nemcsak a mennyiség, hanem a számát őket alkotó NH2 és COOH-csoportokat, valamint a jelenléte a szerkezetükben atomok egyéb elemek, mint például S, Br, I. jelenleg mintegy 26 különböző aminosavat tartozó fehérjék. Körülbelül a felét ez a szám csak egy csoportját NH2 és COOH; ezek egyszerű vagy monoaminokislotami. Egyéb tartalmazhat két COOH csoportot tartalmaznak amin-csoport, és rendelkeznek egy jellegzetes savas tulajdonságokkal. A harmadik csoport az aminosavak hangsúlyos alapvető tulajdonságait, ez tartalmaz egy COOH csoportot nA két aminocsoport. Továbbá, az összetétel fehérjék tartalmaz néhány s-gyűrűs savak bonyolultabb összetételének és szerkezetének a radikális R.
Az első alkalommal a legegyszerűbb fehérje szerkezetét a rendszer adta Fisher (1906) formájában egy polipeptid lánc.
kondenzációs reakciók szerint megy végbe a következő egyenlet
Ez a kommunikáció révén a polipeptid további polimerek kialakítására fehérjék a komplexitás. Mivel az aminosavak száma egységek a molekulák és polipeptidek növeli a számos lehetséges izomerek. Így, angol biokémikus Richard Sindj becslések szerint egy fehérje, amelynek molekulatömege 3400 (viszonylag rövid láncú), minden molekulája, amely 288 aminosavat tartalmaz, és a szerkezet magában foglalja a csak 12 aminosavból, lehet teljesen csillagászati izomerek száma - 10 300. ha sikerülne összegyűlnek csak egy molekula egyes a lehetséges izomerek e hipotetikus fehérje, a teljes tömege ezen molekulák azt jelentené, hogy 10.277 kg. Mivel a Föld lényegesen kisebb, számított tömeg tsifroy- október 24 kg - nyilvánvaló, hogy ténylegesen fennáll a természetben csak több izomer az ezt a második proteint.
A számos fehérje a természetben előforduló, rendkívül nagy. A jelen idejű infúzió több száz különböző fehérje tiszta formában izoláljuk. És a vizsgálatok kimutatták, hogy az összes fehérjék különböznek egymástól kémiai tulajdonságait, minden élő szervezet eléri a több ezer. Gyakran még nézni teljesen azonos fehérjék különböző forrásokból nem mindig azonos összetételű és szerkezetű. Így, az összes különböző életformák bolygónkon megléte miatt több millió egyedi fehérjék, amelyek mindegyike a maga nemében egyedülálló.
A fehérje makromolekula egy nagyon bonyolult rendszer. A ismétlődő egységek az úgynevezett makromolekulák, amelyek mindegyikében tartalmaz egy peptidlánc 4-6 aminosavból és a kialakulása a ciklusos (gyűrűs diketopiperazin).
Tehát a készítmény a fehérjék komplex polipeptidek szerkezetileg és - a nagy molekulatömegű polimereket (vysokopolikondensaty).
Amint számos tanulmány, nem csak az aminosavat a polipeptid-lánc, az egyes helyén, de a nagyon láncok fehérjék vannak elrendezve a megfelelő sorrendben. Elég disturb elrendezése a láncok a molekulában például fehérjét és die változás. Valamint a peptidkötést egy fehérjemolekula, vannak más kommunikációs formák, különösen a hidrogénatom. Ennek eredményeképpen a fehérje makromolekula alapvetően megszerzi a karakter nagyon erős az oktatás.
Számos tanulmány megállapította, hogy az összes fehérje formájában a makromolekulák lehet osztani elsősorban két csoportra - fibrilláris és globuláris.
Fibrilláris vagy szálas fehérjék (a latin szó fibrilláris - rost) állnak makromolekulák formájában hosszúkás, vékony szálak általában egymással. Ez a csoport magában foglalja a fehérjék, amelyek összetevői a bőr és inak (kollagén, zselatin), a haj és a kürt (keratin), izomba (miozin), és mások. A szervezetben működnek elsősorban mechanikai funkciókat, bár néhány fibrilláris proteinek biológiai aktivitással rendelkeznek . Tehát a fent megnevezett miozin egy olyan enzim; lehasad adenazintrifosfornuyu sav (ATP), amely egy nagy mennyiségű energia szabadul fel, amikor a hasítás.
Fibrilláris proteinek szobahőmérsékleten általában oldhatatlan során de, de képesek a duzzadás azt, hogy beszél a hidrofil tulajdonságokkal.
Globuláris fehérjék (a latin szó globula - golyó) áll makromolekulák gömbölyű, elliptikus, ritkán orsó alakú. A jellemző ezek a fehérjék a jól oldódnak vízben, azaz. E. Magas hidrofilitást. Globuláris fehérjék találhatók többnyire a testfolyadékokban: vér, nyirok, a sejtek citoplazmájában. Fehérjék e csoport - az albumin és a globulinok tojásfehérje, tej, a szérum, a gyomornedv pepszint és mások - végzett a test nagyon fontos biológiai funkciókat.
Számos kísérletekkel kimutatták, hogy a természet a kötések a rostos és globuláris fehérjék azonos. A molekulatömege mind a fő szerkezeti fehérje faj is körülbelül azonos (a 30 000 és 1 000 000 vagy több), de a forma szignifikánsan különbözik. Tehát, rostos proteinek makroglobul hossza a több száz és több ezer-szer nagyobb, mint a vastagsága. Például, makroglobula prokollagén egy molekulatömege 680 000 hossza körülbelül 30 nm, és a vastagsága - csak néhány tíz nanométer.
fehérje épül. A stabilitási kolloid részecskék értéke csak a víz, amely létrehozza a külső vízköpeny. Ez volt ő, és megakadályozza, hogy ütközés és társulási fehérje makromolekulák.
Komplex fehérjék állnak az egyszerű makroglobuly fehérjét, amelyhez más alkatrészek kapcsolódnak: .. Szénhidrátok vagy lipidek, foszforsav, stb, ebbe a csoportba tartoznak például a nukleoproteinek, és amelynek szerkezete különösen intenzíven vizsgálták nemrég. Emlékezzünk, hogy nukleoproteineket állnak úgynevezett fehérje-és nukleinsav, amely egy polimer, amely mononukleotidok (monomerek) kapcsolódik össze észterkötések. Mindegyik monomer egy purin (adenin vagy guanin) vagy pirimidin (timin, citozin vagy uracil) bázisok keresztül kapcsolódik a ribóz vagy a dizoksiribozu foszforsavval. Különleges ZNA-chenie így biológiai elektromos töltés a fehérjék, amellett, hogy a sajátos szerkezete, ez egy jellemző tulajdonságaik. A fehérje-molekula két poláris csoportok: az alap - NH2 és a sav - COOH, amely jelentését makromolekula amfoter tulajdonságokkal. A fehérjék nem egyszerűen elektrolitokat és elektrolitok - amfolitek. Ez azt jelenti, hogy a vizes oldatok a makromolekulák disszociálhat például savak, azaz. E. lehasadása hidrogén ionok
és, mint az alap, azaz. e. lehasadása hidroxil ionok
fehérje makromolekulák van egy spirális konfiguráció, amely változhat attól függően, hogy a töltés jel. Tehát egy fehérje semleges állapotban a ellentétes töltésű ionok NH3 + és COO - érzi, hogy erős vonzódnak egymáshoz, ezáltal lerövidítve fehérje szálak és még csavaró neki egy spirál:
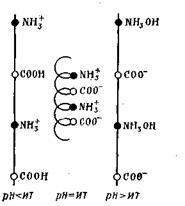
A savas és lúgos közegben a taszítása egyes csoportok és nyújtás a lánc egészének, azaz. E. A letekercselés hélix.
Így a protein-töltés arányától függ annak molekulák karbo-ksilnyh és amincsoportok és a közeg pH-ja. A pH a fehérje oldat, ahol a fehérje válik elektromosan semleges, az úgynevezett izoelektromos pontja a fehérje. Minden egyes fehérjének megvan a pH-ja olyan, hogy locat-izoelektromos állapotban ditsya (Tabl.6.5).
6.5 táblázat A tapasztalat azt mutatja, hogy az izoelektromos állapotban viszkozitása legkisebb fehérjék. Ez annak köszönhető, hogy a változás alakja makromolekulák, mivel makromolekulák a hajtogatás nélküli állapotban ad megoldást a nagyobb viszkozitású, mint a makromolekula, hengerelt egy spirális vagy tekercs.
Kísérleti meghatározása az izoelektromos pont fehérje megoldások, mint az izoelektromos állapotban meghatározása liofil szolok, közvetlen vagy közvetett módszereket lehet előállítani.
A közvetlen módszerek csökken, hogy a megfigyelés a viselkedését részecskék az elektromos mező az elektroforézis során. Ebben az esetben a célfehérje elektroforézisnek vetjük alá pufferoldatokat különböző pH-értékeket. A pufferoldat pH-ja az izoelektromos pont, a fehérje, az utóbbi elektromosan semleges, és nem vándorol elektromos térben. Ezek a megfigyelések végzik makroszkóposan különösen elektroforetikus eszközöket, vagy mikroszkóposán sejtben ultramicroscope. Amellett, hogy a közvetlen módszerekkel megfigyelési léteznek izoelektromos állapotban fehérje és a közvetett módszerek, amelyek csökkenteni, hogy a megfigyelés a maximális vagy minimális fizikai tulajdonság, hogy változik változások a zéta potenciál a vizsgálati oldat. Mindezek a módszerek részletes leírása a vonatkozó kézikönyvekben.