Kvalitatív reakciók fehérjék
Az egyik legfontosabb jellemzője a kémiai reakciók az élő szervezetekben előforduló olyan katalitikus jellegű. Élő sejt is képviselteti magát, mint egy miniatűr katalitikus reaktorban. Ellentétben sejtek lombikból vegyész abban a tényben rejlik, hogy ha a lombikot az összes reakció fordul elő egymástól függetlenül (A végrehajtott reakciók alapelve függetlenség), a sejt előfordul mind összefüggnek.
Ez azért történik, nem azért, mert a fizika törvényei sérülnek vagy a cella alá esik más törvények - nem, néhány törvények vannak élő kérdésekben. Csak a folyamat az evolúció a természet hatékony gépvezérlésre összes celluláris reakciók jött létre, amely lehetővé teszi az egész cella, hogy ellenőrizzék az arány a termékek úgy, hogy optimálisan működjön a reakciók.
Így, az összes biokémiai reakciók - a katalitikus reakció.
Biológiai katalizátorok nevezett enzimek vagy enzimek.
Elvileg, a sejt áramlási ugyanazt a kémiai reakciót, mint a kémiai laboratórium, de a reakciók előírt feltételek szigorú korlátozások a sejtben, azaz a T = 37 # 9702; C és P = 1 atm.
Ezért gyakran a folyamatok zajlanak a laboratóriumban egy lépésben, az élő sejtekben végzett több lépésben.
ÖSSZEFOGLALÁS katalitikus reakciók, annak ellenére, hogy az elosztócső csökken az a tény, hogy a kiindulási anyagok a katalizátor kialakítására közbenső. amely viszonylag gyorsan átalakul a reakciótermékek, regenerálni a katalizátort.
Néha intermedierek izolálhatok tiszta formában, de általában ezek alkotják az illékony molekulák, a detektálás lehetséges csak egy nagyon érzékeny spektrális eszközök.
Az eljárás, amely katalizátor - egy gyűrűs vagy körkörös.
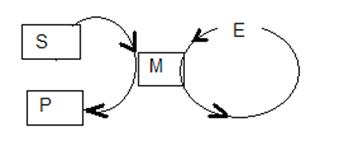
Mérjük az enzimaktivitás - a fordulatok számának (a mólszáma szubsztrát változóban 1 percig szempontjából 1 mol enzim)
A fordulatok száma elérheti a 10 8..
Elég gyakran ciklusok több katalizátorok kialakítva egymáshoz egy ciklikus folyamat.
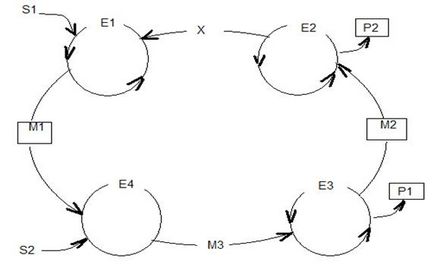
Anyagok az S1 és S2 alakítjuk termékek P1 és P2. A konvertálás folyamán, az első S1 reagál egy harmadik X anyagot és a katalizátort E1, M1 képező közbenső terméket, amely viszont által azt jelenti, E2 alakítjuk a katalizátor közbenső M2 és t. D.
A gyorsító hatása a katalizátort csökkenésével jár aktiválási energia (ez az a járulékos energiaráfordítás, amely közölni kell egy mól az anyag a részecske anyagok reaktív és lehetett leküzdeni az energia akadályt a reakció).
A fő tulajdonságai enzimek:
- hatékonyság, ami gyorsulásának mértékét (gyorsulás 100 millió alkalommal).
- megnövekedett szubsztrát specificitás. Az enzimeket különböztetni a biológiai szubsztrát felismerésben (komplementaritás).
- fokozott specificitás a katalizált reakció. A legtöbb enzimet felgyorsítja a reakció típusától.
- megnövekedett specificitással képest az optikai izomerek (képes felismerni bal és jobb izomerek).
Ennek oka az összes egyedi tulajdonságait enzimek - a térbeli szerkezete. Jellemzően, ezt a globuláris fehérjék, messze felülmúlja a méret a szubsztrát. Ez vezet az a tény, hogy az evolúció során az enzim felületén a képződött aktív hely, amely komplementer a szubsztrát. Ez a zár és a kulcs.
Hagyományosan, az aktív helyek vannak osztva: a kötési és katalitikus.
Kötőhely kötődik a szubsztrát és optimálisan orientálja felé a katalizált csoport, katalizálja az ugyanabban a központban középpontjában az összes aktív csoportokat.
Ha a reakció elvégzéséhez szükséges a hidrolízis (fehérjék, lipidek), a középső van kialakítva katalizált oldalán gyökök AK - maradékok.
Ebben az esetben, az enzim áll polipeptid láncok. Mellett azonban a hidrolitikus reakció következik be és mások: redox reakció ruház át csoportok.
Ezekben az esetekben, az enzim tartalmazza a nem-fehérje része. Ez a rész - koenzim (rofaktor, prosztetikus csoport). A protein rész biztosítja a kötelező érvényű intézkedése, és a koenzim - katalitikus. Fehérje rész - apoenzimmel.
Apoenzimmel + koenzim ↔holoferment