Szilárdanyag (szerkezetét és tulajdonságait)

Home | Rólunk | visszacsatolás
A szilárd anyagokat az atomok vannak elrendezve relatív módon (egymáshoz képest), amely biztosítja a jelenléte az állandó kapcsolat közöttük. Quantum mechanikai Schrödinger egyenlet természetét leíró a mozgás az elektronok az atom lehetővé teszi, hogy megmagyarázza a természet a kötések az atomok között keletkező képződése során a kristályos szerkezet szilárd anyagok. Amikor elegendő konvergencia atomok (molekulák) között egy vezető kölcsönhatás a megjelenése erők vonzás és taszítás-CIÓ.
A leggyakoribb típus a kommunikációs között előforduló bármely Mami-atomok és molekulák a Van der Waals-erő. Ez az első alkalom ezeket a hatásköröket vezették megmagyarázni az eltéréseket a valódi gázok a állapotegyenlet az ideális gázok. Ebből származik a nevük. Az egyenletben van der Waals
Ezek az erők határozzák meg a korrekció (A / V 2). B A módosítás figyelembe veszi a hatását taszító erők.
A figyelemre méltó tulajdonsága a Van der Waals erők, hogy azok között felmerülő elektromosan semleges rendszerek, valamint a rendszerek, amelyek nem rendelkeznek elektromos pillanatban. Amikor az inter-akció a inert gáz, ők az egyetlen erők de-ugatás esetleges folyékony és szilárd állapotban ezen anyagok.
Atomok szemben a periódusos rendszerben együtt egy inert gáz, van egy olyan tendencia, hogy vegye őket config-talkie által visszarúgás elektronok vagy elfogadás. Ha az alkálifém-atomot, állva közvetlenül mögötte a közömbös gázok, a vegyérték-elektron-edik mozgó réteget feltöltöttük és a gyengén kötődő a sejtmagba. A halogének, állva közvetlenül előtte a m-inert Zami hiányzik egy elektron, hogy töltse stabil réteg a nemesgáz. Ezért van egy nagy affinitással egy további elektron.
A kapcsolat e fajta atomok, m. E. között tipikus Me-halogenidek és tallium a következőképpen. BHA Chal jelentése ionizált atomok mind egy elektront a fématomhoz mozog a halogénatom. Ebben előnézet raschaetsya fématom egy pozitív töltésű ion, halogénatom - a-a-negatív töltésű ion. Ezek az ionok kölcsönhatásba egymással Coulomb-törvény, mivel a két ellentétes töltésű. Az ilyen kötés az úgynevezett ionos vagy poláris.
A jelenléte kétféle kötvények (poláris és van der Waals-erők) nem tudja megmagyarázni a létezését nagy szárazanyag. Különösen homogén atomok nem képeznek, nyilvánvalóan, ellentétes töltésű ionok által újraelosztása vegyérték elektronok, mint ahogy az a kölcsönhatás a fém-halogenidek. Tény, hogy a szilárd anyagok, amely azonos atomok, rájött, hogy milyen típusú a kovalens kötés. Ez a fajta kapcsolat is nevezik kovalens és cseréjét.
Kovalens kötés fordul elő, amikor atomok egymáshoz közelítenek, hogy az azonos jellegű (így például A-atom és B atom). Tekintsük e két vegyérték elektronok az atomok (1 és 2). A magok ezen atomok jelölése a és b. Annak a ténynek köszönhetően, hogy a sűrűsége a elektron felhő, amely leírja az állam az elektron egy atom, leesik gyorsan távolságot, találni egy elektron a sejtmagban 1 b, a mag elektron 2y, mint nagyon valószínűtlen. Számítás azt mutatja, hogy r = 50 A, minden egyes elektronok lehet menni egy „idegen” kernel egyszer átlagosan 10 és 12 éves. Ezért, a és b atomok lehet tekinteni, mint izolált és az energia a rendszer, amely az ilyen atom meg kell egyeznie a 2E0, ahol E0 - energiát izolált tartalmaz a normális állapotban.
Mivel a valószínűsége átmenet atomok elektronjainak a konvergencia a „másik” magok növekszik. Kellően közötti kis távolság az atommagok az atomok bekövetkezik érzékelhető átfedés elektron az atomok és az átmenetet da frekvencia megnő körülbelül 14 másodperc és körülbelül 10 -1. A további közelítése az fokú átfedés elektron felhők és növeli a gyakorisága csere oldalak úgy megnő, hogy értelmetlen beszélni egy elektront egy atom tartozó 1 A. 2k atom és elektron V. Ez megfelel a megjelenése egy új állapotban, nem jellemző, hogy egy olyan rendszer, amely két izolált atomok és a figyelemre méltó tény, hogy az elektronok ebben az állapotban tartozik egyszerre mind magok, vagy mint az említett szocializált.
Van egy másik fajta közötti kapcsolatok azonos atomok - fém kötés. Egy ilyen kapcsolat jellemző fémek a fémrács oldalak pozitív töltésű ionok, chi-dasági közötti kapcsolat útján, annak szabad elektronok, alkotó elektron gáz. Fémes kötés nem fordul elő, amikor egy kis számú vegyérték elektronok, és ezért azok gyengén kötött atommagok. Amikor Obra mations-fém elektron vegyérték-elektronok fedik egymást, így vegyérték elektronok megkapja LEHETÕSÉGÉRÕL mozog az egyik atom a másikra, és szabadon fordulási schatsya kristály. Szabad elektronok pozitív kapcsolatban ionok egy szilárd szerkezetté. A fémes kötés rugalmasabb és rugalmas, mint ion. A fémek, az elektronok szocializáció történik; ezek az elektronok tartják az atomok közötti. Abban az esetben, fémes kötés szocializációs vegyérték elektronok részt valamennyi atom a kristály és a megosztott elektronok nem lokalizálódik már atomjaik és szabadon NE-utazás körülbelül belül a teljes tömböt.
Meg kell jegyezni, hogy a legtöbb általános kommunikációs kapcsolat egy van der Ba-ALS. Ez akkor fordul elő, minden esetben, kivétel nélkül. Ugyanakkor ez - a leggyengébb láncszem energiával nem haladó EDI-le 10 március 8 × J / mol.V tiszta formában úgy tűnik, a kölcsönhatás-Corollárium semleges atomok és molekulák, amelyek vnut-Rennie töltött elektronhéjak. Különösen, a Van der Waals-erő határozza meg a létezését folyékony és szilárd állapotok, inert gázok, hidrogén, oxigén, nitrogén és számos szerves és szervetlen vegyületek, amelyek kapcsolatot egy hatalmas csoport NE vegyértékei molekuláris kristályok; ez lesz részletesebben tárgyaljuk az alábbiakban. Mivel az energia a van der Waals erők alacsony, mind a szerkezetek miatt ezt a kötést, malous-fenntarthatatlan könnyen illó, és alacsony az olvadáspontja.
Az ionos kötés tipikusan egy kémiai kötés, széles körben elterjedt a szervetlen vegyületek. Ezek otno-syatsya fémvegyületek halogénekkel, fém-oxidok, sul táplálja és sok más poláris vegyületek. A ion-vezető összeköttetés Preece is többféle intermetallikus vegyületek (karbidok, szelenidek, nitridek, stb). Az energia az ionos kötés sokkal nagyobb energia Van der Waals erők: ez a mennyiség körülbeiül 6,7 × október 5 J / mol (a KCl) 7 1,5-10 J / mol (az Alu-minum oxid és króm). Ezért, szilárd test egy ionos kötést magas hő szublimációs és magas az olvadáspontja.
A kovalens kötés rendkívül eléggé elterjedt-nenie a szerves vegyületek, de megtalálható a nem-szerves vegyületek, egyes fémek, valamint a set-GIH intermetallikus vegyületeket. Ez a kötés határozza ob transzformáltja vegyérték típusú kristályok gyémánt, germánium, stb vegyértékkötés energia magas: .. egyszeres kötés „szén - szén” (C - C) organi-idézésben vegyületek energiája a sorrendben 3-10 5 J / mol. ez ugyanaz az értéke, és ez a kapcsolat a gyémánt rács, a SVR-lyére magas olvadáspontú és nagy hő szublimációs.
Végül, a fémes kötés, eredő szocializációjára vegyérték elektronok jellemző tipikus fémek és számos, egymáshoz fémvegyület. Az energia ennek a kapcsolatnak, nagyságrendileg hasonló a kötési energiája a vegyérték.
Hangsúlyozni kell, hogy a valós szilárd, mind a helység kapcsolatok tiszta formájukban szinte soha nem fordul elő. Szinte mindig van egy egymásra két vagy több típusú kapcsolatokat. Egyikük egy általánosan uralkodó jelen-értékét, megállapítjuk a szerkezetét és tulajdonságait a szervezetben.
A helyes leírását a belső szerkezete szilárd vagy használja a kifejezést térbeli-rács kristályosodás.
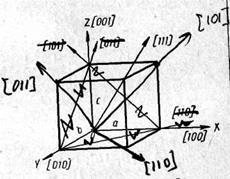
Ebből a táblázatból nyilvánvaló, hogy attól függően, hogy az irányt a kristály tulajdonságai nagymértékben változhat.
A záró Ebben a fejezetben figyelembe vesszük az eltérő fizikai tulajdonságai mono- és polikristályos anyagok.
Különleges esetekben a szilárd nőhet, mint egy kristály - egykristály. Azonban gyakrabban megtörténik az olvadék egyidejűleg nagyszámú kristály-CIÓ a központok, aminek következtében a növekedés számos egykristály arcokat. Bővül, fokozatosan közelednek egymáshoz, együtt fejlődnek, és alkotnak egy darabból álló konglomerátum - polikristályos. Olvasztott krisztallitok (szemes) általában formájában szabálytalan poliéderek, a külső darabot, amely nem tükrözi a helyes belső szerkezetét. Mivel az elosztó és orientációja a kristályosodási magok belül a hűtési olvadék-Sauveur Chennault véletlenszerű, és a relatív orientációját a gabona-egymással fúzionált, hanem véletlenszerű. Ezért polikristályos nem mutat jelentős függőség a tulajdonságok az irányt - ez izotróp.
Ezen túlmenően, a különbség a orientációban intergrows szemek vezet szemcsehatárokon, render-nek erős befolyást a kialakulását a mechanikai tulajdonságok polikristályos aggregált. Még egy rendkívül tiszta fém lényegében nem tartalmazó szennyeződéseket a kristályrácsban torz intercrystalline rétegek. Torzítás nem korlátozódik egy egyrétegű határ JELÖLI atomok, és kiterjeszti több réteg mély, amely határoló atomok kölcsönhatásba lépnek. A nagyobb mértékű a zavar a gabona határán, a szélesebb átmeneti zónában, és annál erősebb torzul.
kristályrács torzítás a intercrystalline pro-felfújja az oka lokalizációs ott, ha feleslegben-művelet-szabad energia. Ezt támasztja alá számos kísérletet. Így, Chalmers találtuk, hogy igen tiszta Sn szemcsehatárokon olvadni kezd egy kissé alacsonyabb hőmérsékletű, mint a szemek magukat. A diffúzió sebessége a szemcsehatárok mentén, mint ömlesztve. Nukleálását új szemes átkristályosítás közben kezdődik általában a határokat a régi, vagy olyan helyeken, ahol a kiszivárgott legsúlyosabb képlékeny, at-vívott zavar a kristályrács. Ha a fém szennyeződés-holding, amikor ezek a szennyeződések vannak allokálva a kristályosodás általában a szemcsehatárokon, ami előfordulása intercrystalline rétegek, annak összetétele és tulajdonságai drasztikusan Otley-tens a szemek magukat.