Boyle-törvény - studopediya
anyagi paraméterek bármely társult állapot állapotegyenletre egymással, melynek formája az esetek többségében ismeretlen. Csak a gázok, a részecskék, amelyek kellően távol egymástól, és szinte nem lépnek kölcsönhatásba, ilyen egyenlet ismert viszonylag pontosan.
Tekintsünk egy gáz egy zárt térfogatot (ábra. 1.1), azaz amelynek paramétereit (hőmérséklet, nyomás, sűrűség) azonos az egész, és változatlan. Ez a rendszer az egyensúlyi. Ha lassan csökkenti a hangerőt a rendszer, miközben annak hőmérsékletét állandó, akkor azt láthatjuk, hogy a gáz nyomása a rendszerben növekszik, és ha megnevezzük a kezdeti nyomás és térfogat, mint a P0 és V0. és az utolsó - mindkét P1 és V1. arra lehet következtetni, hogy a termék a gáznyomás és a térfogat állandó bármely ponton a folyamat. Azaz P0 V0 = P1 V1 = const T = const.
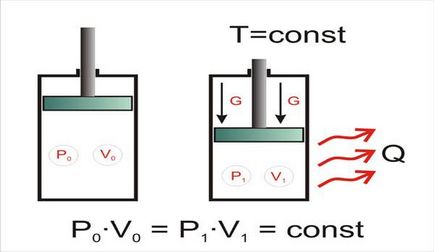
Ábra. 1.1. izotermikus kompresszió
Ezt a kapcsolatot az úgynevezett Boyle-törvény, és az alábbiak szerint történik: a termék mennyiségének egy adott tömegű gáz a nyomás állandó állandó hőmérsékleten.
Process eljárásban állandó hőmérsékleten, az úgynevezett izoterm. Valódi folyamat gáz kompressziós, például, a kompresszor nem izoterm - térfogat csökkentésére és a nyomás növekedése kíséri a hőmérséklet emelkedése. Azonban, ha a sűrített gáz hőmérsékletre hűtjük, amely előtt volt tömörítés, akkor látható, hogy a kezdeti és a végső értékeket a térfogat és a nyomás a törvény Boyle megfigyelt.
Ha képviseli az izotermikus kompresszió folyamata gáz formájában egy grafikon, egy tengelye, amely a kötet fog számítani, és a következő - a nyomás (az úgynevezett PV-diagram -. 1.2 ábra), a kijelző a törvény Boyle-Mariotte törvény, hogy a pontok a gráf sokaságát csúcsainak téglalapok az egyenlő nagysága:
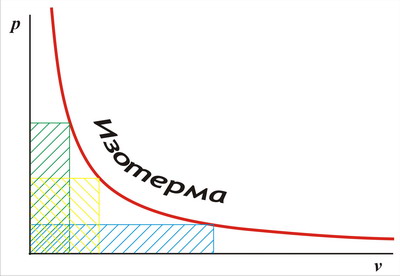
Ábra. 1.2. PV-diagram