látens hő
Fizika> Látens hő
Látens hő - energiát társított változása halmazállapot.
tanulási feladat
- Tekintsük a látens hőt, mint az energia egyik formája.
A főbb pontok
- Energiára van szükség, hogy változtatni az állam egy anyag (például, hogy megszünteti a kötéseket a molekulák közötti a jég olvad meg).
- A változás az energia állapotokat lehet hozzáadni vagy elvenni, de a hőmérséklet stabil marad (a változások csak a legvégén).
- A szükséges hő a fázisváltozás: Q = MLF (olvadási vagy fagyasztás) és Q = MLV (kondenzáció vagy párolgás), ahol Lf és Lv - látens hője megolvadása és elpárolgása.
- A szublimációs - az átmenet a szilárdtest gőzök, megkerülve a folyékony fázis.
- A párolgás rejtett hője - az energia, ami szükséges, hogy menjen a folyadék gőz.
- A látens fúziós hője - energia, amely szükséges az átmenetet a szilárd anyag folyékony.
látens hő
Nézzük meg a vizet leengedik a jégcsapok olvadó a tetőn a napsütésben. Továbbá, a víz megfagy az aknában.

Hőt a levegő át a jeget, ami olvadás
Szüksége van egy bizonyos mennyiségű energiát a szilárd anyag megolvad. Azt kellett volna szét a kötött molekulákat, hogy biztosítsák számukra a mozgást. Továbbá, a szükséges energiát, hogy elpárologjon. Amikor az állam változik, a hőmérséklet ugyanaz marad. A felszabaduló energia hő formájában, és a munkát kombinálásával erők összege a molekulák.
Energia két tényezőtől függ: az az összeg, és ereje kapcsolatokat. A kötések száma mellett arányos a molekulák száma, és ezért a testsúly. A szilárdság típusa alapján a molekulák. A hő a következőképpen számítjuk ki:
Q = MLF (olvadás vagy fagyasztás).
Q = MLV (kondenzáció vagy bepárlás).
Ott Lf - látens fúziós hője, egy Lv - a párolgás rejtett hője.
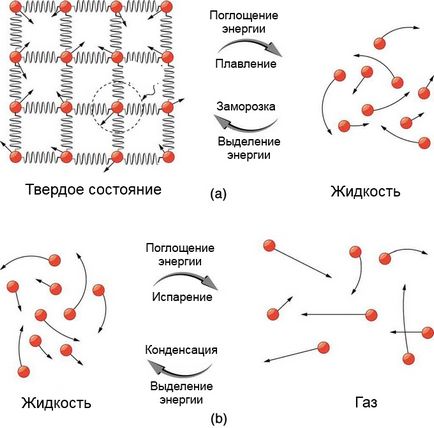
(A) - A fordított energia leküzdésében részleges vonzó- közötti molekulák a szilárd állapotban az átalakulás egy folyadék. Ő visszavonult a fagyasztási eljárás során. (B) - A molekulákat egymástól nagy távolságokra való átmenetnek a folyadékpárolgási, így szükség lesz egy csomó energiát leküzdeni molekuláris vonzás. Amikor az állam változik, a hőmérséklet kijelző ugyanaz marad
Látens hő - intenzív tulajdonság kifejezve J / kg. Az LF és az Lv függ anyagok, különösen a molekuláris erők. Ez együtthatók látens hőt. Ha megváltoztatja az állam a szolgáltatott energia és le anélkül, hogy a hőmérséklet-változások, ezért úgy tekinthető rejtett. Olvadáspont és bepárlás a endoterm folyamat, mert elnyeli az energiát, és a fagyasztás és kondenzációs - exoterm, megjelenése óta.
Az energia társul az állam. Tegyük fel, hogy meg kell olvadni egy kilogramm jeget, hogy egy kilogramm víz 0 ° C-on Tekintsük az egyenlet a hőmérséklet-változás és az értéket a víz (334 kJ / kg), hogy megkapjuk Q = MLF = (1,0 kg) (334 kJ / kg) = 334 kJ. Ez az energiamennyiség, amit meg kell tölteni olvadó vizet. Mert párolgás több energiára van szükségük. 1 kg víz megy át gőz 2256 kJ.
Változások állam stabilizáló hatással. Hozzáadás hőt a jég -20 ° C hőmérsékleten. Először is, a hőmérséklet emelkedik lineárisan elnyelő hőstabil aránya 0,50 cal / g⋅C eléréséig nulla. Ott jég olvadni kezd, és a végső szakaszban fogja elnyelni 79,8 cal / g hőt. Amint az olvadási folyamat befejeződött, a víz hőmérséklet-növekedés, elnyelve a hőt egy új állandó sebességgel 1,00 cal / g · C. A hőmérséklet 100 ° C-on forr elindul, és a hőmérsékletet jelző ismét stabil, amíg a víz elnyeli 539 cal / g hőt. Amikor az összes folyadék alakítjuk gőz, a hőmérséklet ismét emelkedik, elnyelve a hőt sebességgel 0,482 cal / g⋅S.
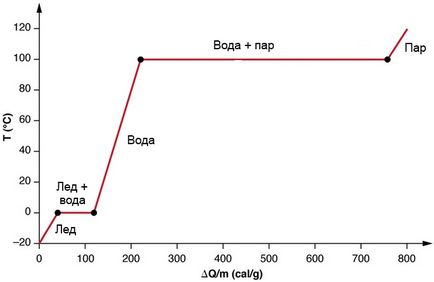
Ez a grafikon azt mutatja, hogy a hőmérséklet függ az energiát. Itt a gőz nem párolog, amíg felmelegszik a jég válik a folyékony víz. Hosszú szakaszok a stabil hőmérsékletet mutatók 0 ° C és 100 ° C jelezné jelentős látens hője olvadási és párolgási
Vizsgálat átmeneti állapotok - szublimációs (a szilárd halmazállapotból gőz). Van is egy fordított folyamat - lerakódás. Megvan a saját szublimáció látens hő Ls.