komplex vegyületek
Laboratóriumi munka 11
Átfogóan nevezett vegyületet a kristályrácspontjaiban, komplex ionok, önmagában is előforduló oldatban. Például, K2 [HgI4], [Cu (NH3) 4] Cl2.
Az ilyen komplex vegyületek képződnek vegyületek semleges molekulák képződése nélkül új elektron pár:
Szerint koordinációs elmélet Werner egy atom a komplex ion (általában pozitívan töltött), amelyeknek a központi atomja (komplexképző szer). Mintegy által koordinált több anionos vagy semleges molekula - ligandumok, hogy együtt a központi atom, hogy a belső gömb a komplex vegyület vagy komplex ion. A képletekben komplex ion (koordinációs szféra) kiosztott zárójelben. A maradék ionok alkotják a külső gömb a komplex. Így a K2 [HgI4] Hg 2+ - komplexképző; ionok I - - ligandok; ionok K + - külső szférában.
A komplex iont tartalmaznak mind eltérő ligandumok. A komplex [Co (NH3) 3 (H 2O) 2 Cl] 2+ molekula ligandumként NH3. H2 O ion és a Cl -.
A ligandumok száma körülvevő komplexképző szer, az úgynevezett koordinációs száma (cn) a komplexképző szer, például:
Gyakran, de nem mindig, a koordinációs szám kétszerese a díjat a komplexképző szer. A koordinációs szám többféle komplexképző szerek nem állandó.
A díjat a komplex ion egyenlő az algebrai összege díjak és komplexképző ligandumok. Így az ion [Fe (CN) 6] x tartalmaz Fe 2+ és a komplexképző ligandumok - CN-ionok -; ezért x = + 2 + 6 (1) = -4. A ion [Co (NH3) 4 Cl2] x tartalmazza komplexképző ligandumok és Co 3+ - NH3 molekulák (nincs töltés) ionok és a Cl -. ezért x = + 3 + 4 (0) +2 (-1) = +1.
A legtöbb elektrolitok komplex vegyületek oldatok és komplex ionok disszociálnak, és az ionok a külső gömb (elsődleges disszociációs):
Komplex ionok oldatban, hogy kisebb vagy nagyobb mértékben a komplexképző reverzibilisen disszociálnak és ligandumok (másodlagos disszociációs):
Az egyensúlyi disszociációs állandót a másodlagos folyamatot nevezik KH instabilitása állandóit komplex ionok:
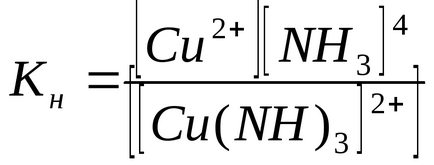
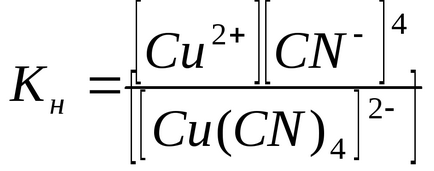
A mennyiség Kn meghatározza az erejét a komplex ion: minél kisebb, annál stabilabb a komplex ion. Az adatok azt mutatják, hogy a komplex ion [Cu (CN) 4] 2- sokkal erősebb ion [Cu (NH3) 4] 2+.
Erősíteni a disszociációs a komplex ion, és akár tönkre is melegítéssel, hígítás, anyagok hozzáadását, hogy a komponensek egyike komplex ion formájában még kevesebb disszociált molekulák és ionok. Például, a komplex ion [Ag (NH3) 2] + (Bk = 6,8 ∙ 10 -8) lehet semmisíteni hozzáadásával Ni2 + ionok. mivel Ni2 + -ion formában ammóniával molekulákkal tartósabb összetettebb ion [Ni (NH3) 6] 2+ (Kn = 2,0 ∙ 10 -9):
Hozzáadása egy erős sav, hogy komplex ionok tartalmazó NH3 molekulák. Ez vezet a pusztulástól. savas hidrogén-ionokat és molekulákat NH3 képeznek stabilabb ionok NH4 +:
Komplex vegyületek, amelyek vizes oldatban szinte teljesen bonthatók egyszerű ionok és molekulák az úgynevezett kettős sói. Így a kettős só KFE (SO4) 2 disszociál a következő egyenlet alapján:
és minden ionok keletkeznek az oldatban, lehetőség van arra, hogy észleli a megfelelő reakciókban. A kettős só képletű nélkül rögzítjük szögletes zárójelek: NaAl (SO4) 2. KMgCl3.
Cél -, hogy megtanulják az alapvető előállítási módszerek és az egyes kémiai tulajdonságainak komplex vegyületek.
Berendezés és anyagok: olyan állványt kémcsövekben.
Reagensek: magnézium port, lakmuszpapír, Univerzális indikátor papír, szűrőpapír, az oldatot: alumínium-szulfát, nátrium-hidroxid (2,1 N tömény ..), réz-szulfát, ammónium-hidroxid tömény. vas-ammónium-kvastsovNH4Fe (SO4) 2, ammoniyaNH4NCS tiocianát, bárium-klorid, nátrium-klorid, ezüst-nitrát, salétromsav (2.1 n.), nikkel-szulfát.
1. kísérlet A vegyületek előállítását egy komplex anion (komplex alumínium-vegyület)
Egy kémcsőben 5 csepp oldatot Al2 (SO4) 3 túlfeszültség hozzácsepegtetjük nátrium-hidroxid (NaOH). A kapott csapadékot Al (OH) 3 hozzáadásával feloldjuk feleslegben alkálifém kicsapódni. Létrehozása molekuláris és ionos reakció egyenletek képződését alumínium-hidroxid és a nátrium-tetragidroksoalyuminata. Írjon egy kifejezést a bizonytalanság állandó a komplex ion.
2. kísérlet vegyületek előállítása egy komplex kation (réz amin)
A koncentrált oldattal réz-szulfát CuSO4 (5 csepp elegendően) túlfeszültség-tömény ammónia-oldatot először egy kék csapadék réz gidroksosulfata, majd amíg feloldódik (oldat képződése kék). Írja molekuláris és ionos egyenletek a reakciók, a megfelelő transzformációk:
Írjon egy kifejezést a bizonytalanság állandó a komplex ion.
3. kísérlet A különbség a kettős só komplex vegyületek
Pour három csőbe 5 csepp oldatot vas-ammónium-timsó NH4 Fe (SO4) 2. Egyikük adjunk hozzá néhány csepp ammónium-tiocianát NH4 NCS; egy másik túlfeszültség kis BaCl2 oldatot; egy harmadik, hogy adjunk egy koncentrált nátrium-hidroxid oldat NaOH és enyhén melegítjük. Figyeljük meg a megjelenését a vörös szín az első csőbe, fehér csapadék képződik, a második, és kinyerjük az ammónia a harmadik jellegzetes szag (ammónia, mint detektáltuk elszíneződése nedves indikátorpapírral, márkajelzésű megnyitása csövek).
Írja az ionos egyenletét a reakciót. Megállapításához, hogy a só alum (kettős vagy komplex). Létrehozása egyenlet elektrolitos disszociáció ammónium-vas-timsó.
2. A csövet, amely 5 csepp hexacianoferrát (III) K3 Kálium [Fe (CN) 6] hozzáadunk néhány csepp ammónium-tiocianát NH4 NCS. Miért nem egy vörös színű? Keresse az egyenlet az elektrolitos disszociáció a ferrát (III) kálium.
4. kísérlet megzavarják a komplex ion. Kialakulását egy új, tartósabb komplex ion
A diamminserebra oldatot [Ag (NH3) 2] Cl öntsük egy kémcsőbe egy NaCl oldattal (1-2 cm 3), körülbelül 1 cm 3 AgNO3 oldatot. A csapadékot feloldjuk ezüst-klorid fölös ammónia.
Az így kapott só-oldatot [Ag (NH3) 2] Clrazlit két kémcsőbe. Az egyikben oldatához hozzáadjuk salétromsav kisloty.Obyasnit kicsapódnak levelet molekuláris és ionos egyenletek a reakciók és a pusztítás a komplex ion.
Egy másik kémcsőben hozzá NiSO4 oldatot. ismét, a fehér csapadékot AgCl. Létrehozása molekuláris és ionos formája az egyenlet a reakció, ami azt jelenti, hogy a geksaamminnikelya-szulfát (II) van kialakítva mellett ezüst-klorid csapadék válik ki.