Oxigén és jellemzői
Általános jellemzők oxigén
Oxigén - nyolcadik elem a periódusos rendszer. Rendeltetése - Körülbelül a latin «oxygenium». Található, a második időszakban, VIA-csoport. Arra utal, hogy a nem-fémek. 8. A nukleáris díjat.
Oxigén - a leggyakoribb elem a földkéregben. A szabad állapotban van a levegőben, kötött formában a víz egy részét, ásványok, kőzetek és minden olyan anyagot, amely épülnek a szervezetek a növények és állatok. A tömeghányada az oxigén a földkéreg mintegy 47%.
Egy egyszerű anyag oxigén gáz színtelen, szagtalan. Ez valamivel nehezebb, mint a levegő: tömeges 1L oxigén normál körülmények között 1,43 g, és 1 liter levegő 1,293g. Oxigén oldódik vízben, bár kis mennyiségben: 100 térfogatrész vízben 0 ° C-on feloldunk 4,9 és 20 o C-on - 3,1 térfogat oxigén.
Atomic és molekulatömege az oxigén
A relatív atomtömeg Ar - a moláris tömege az anyag atom, említett 1/12 a moláris tömege szén-12 atom (12 C).
A relatív atomtömeg egyenlő a atomos oxigén 15.999 amu
A relatív molekulatömeg úr - a moláris tömeg egy molekula, hivatkozott 1/12 a moláris tömege szén-12 atom (12 C).
Ez dimenzió velichina.Izvestno hogy egy molekula kétatomos oxigén - O2. A relatív molekulatömege az oxigén molekulák lesz egyenlő:
Allotrópia allotropic módosítások és oxigén
Oxigén létezhetnek két allotropic módosítások - oxigén O2 és az ózon O3 (fizikai tulajdonságait oxigén fentiekben ismertettük).
Szokásos körülmények között az ózon - gáz. Oxigén lehet gyűjteni egy erős hűtés; ózon kondenzálódik a kék folyadék, forráspontja (-111,9 ° C).
Oldhatóság Az ózon vízben lényegesen nagyobb, mint az oxigén: 100 térfogatrész vízben 0 ° C-on feloldunk 49 térfogatrész ózon.
ózon oxigén- lehet alábbi egyenlet fejezi ki:
oxigén izotópok
Ismeretes, hogy a jellege oxigén lehet formájában három izotópok 16 O (99,76%), 17 O (0,04%), és a 18 O (0,2%). A tömeges számok 16, 17 és 18, ill. A magja egy oxigénatom izotóp 16 O tartalmaz nyolc protonok és nyolc neutronok és izotópok 17 O és 18 O- protonok száma megegyezik, neutronok kilenc és tíz, ill.
Vannak tizenkét oxigén radioaktív izotópok tömegszáma 12-24, amelynek legstabilabb izotópja 15 O egy felezési 120 másodperc.
Az oxigén ionok
A külső energia szintjét az oxigénatom hat elektronok, amelyek a vegyérték:
Ábrája oxigénatomok alábbiakban látható:
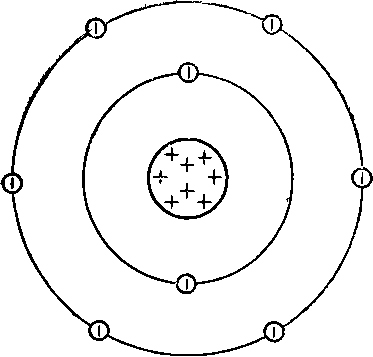
Ennek eredményeként a kémiai kölcsönhatás az oxigén elveszíthetik a vegyérték elektronok, azaz legyen a donor, és át pozitív töltésű ionok vagy felvesznek elektronokat egy másik atom, vagyis legyen az elfogadó, és légy negatív töltésű ionok:
O 0 + 2e → O 2-;
0 -1e → A 1+.
Molekula és oxigénatom
oxigén molekula áll két atom - O2. Bemutatunk néhány jellemző tulajdonságok atom és egy oxigén molekula: