Visszafordíthatatlanságát termikus eljárások
ahol δ Q i = δ Q 1 i + δ Q 2 i - keletkező hőmennyiség a működő szervezetben parcellák két izotermikus hőmérséklet T i. Elvégezni ilyen bonyolult ciklus reverzibilis módon, a munkaközeg kell eredményeznie termikus kapcsolatban számos hő tározók hőmérséklet, T i. Az arány a δ Q i / T i nevezzük a redukált hő. Az így kapott egyenlet azt mutatja, hogy a teljes hőt adott semmilyen reverzibilis ciklus nulla. Ez a képlet lehetővé teszi számunkra, hogy egy új fizikai mennyiség úgynevezett entrópia és betűvel jelöljük S (R. Clausius, 1865). Ha termodinamikai rendszer átlép az egyik egyensúlyi állapotból a másikba, hogy megváltoztatja az entrópia. Entrópia különbség a két Államokban adott hő rendszer által kapott reverzibilis átmenet az egyik állapotból a másikba.
Abban az esetben, reverzibilis adiabatikus folyamat δ Q i = 0, és ezért, az entrópia S változatlan marad.
A kifejezés a változás entrópia átmenetnél δ S szigeteletlen rendszer egyik egyensúlyi állapot (1) egy másik egyensúlyi állapotban (2) felírható
Entrópia határozzuk akár állandó kifejezés, valamint, például, a potenciális energia egy test a erőtér. A fizikai értelmében a különbség δ S az entrópia a rendszer két állapotban. Ahhoz, hogy meghatározzuk a változás entrópia esetében visszafordíthatatlan átmenet a rendszer egyik állapotból a másikba, meg kell gondolni néhány reverzibilis folyamat összekötő kezdeti és végső állapotok, és segítenek megtalálni a csökkentett hő keletkezik, mint egy átmeneti rendszert.
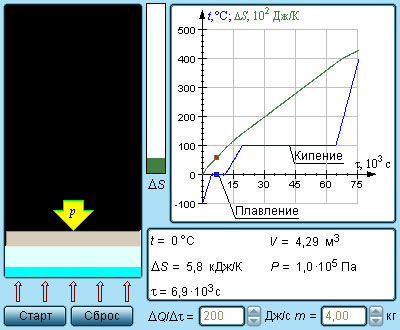
Modell. Entrópia és fázisátalakulások
Ábra. 3.12.4 szemlélteti visszafordíthatatlan gáztágulásos „a semmiben” hiányában a hő. Csak a kezdeti és a végső állapotban a gáz ebben a folyamatban egyensúlyban vannak, és leírhatók a diagramban (o. V). Pontok (a) és (b), amely megfelel ezen államok fekszenek ugyanazon izoterma. Ahhoz, hogy kiszámítsuk δ S entrópiaváltozás tekinthetjük izoterm reverzibilis átmenet (a) (b). Mivel a izotermikus expanzió a gáz kap egy bizonyos mennyiségű hőt a környező szervek Q> 0 lehet következtetni, hogy az irreverzibilis gáz tágulása entrópia növekszik: δ S> 0.
bővítése a gáz az „üres”. Entrópiaváltozás ahol A = Q - munkagáz egy reverzibilis izotermikus expanzió
Egy másik példa a visszafordíthatatlan folyamat - hő egy véges hőmérséklet-különbség. Ábra. 3.12.5 két test látható zárt adiabatikus héj. Kezdeti testhőmérséklet T 1 és T 2
Hőátadás egy véges hőmérséklet-különbség: egy - az eredeti állapot; b - a végső állapot a rendszer. A változás az entrópiában δ S> 0
A növekedés a entrópia egy általános tulajdonsága, az összes spontán előforduló visszafordíthatatlan folyamatokat izolált termodinamikai rendszerekben. A reverzibilis folyamatok az entrópia változatlan marad az izolált rendszerek:
Ez az arány az úgynevezett entrópia törvénye.
Ha bármely folyamatok izolált rendszerek termodinamikai entrópiája akár ugyanaz marad vagy növekszik.
Így, az entrópia irányát jelöli spontán előforduló folyamatok. A növekedés entrópia jelzi azt a megközelítést a rendszer termodinamikai egyensúly. Egyensúlyban az entrópia maximális. A törvény a növekvő entrópia lehet venni, mint egy másik megfogalmazása a termodinamika második törvénye.
1878 Boltzmann adott valószínűségi értelmezést az entrópia. Azt javasolta, hogy fontolja meg a entrópia statisztikai mérőszáma rendellenesség zárt termodinamikai rendszer. Minden spontán előforduló folyamatokat egy zárt rendszerben, hozza a rendszer egyensúlyi állapotban, és kíséri növekedése entrópia felé irányulnak növeli a valószínűségét az állam.
Minden olyan állapot makroszkopikus rendszer, amely tartalmaz egy nagy számú részecske lehet megvalósítani sokféleképpen. A termodinamikai valószínűség W a rendszer állapota - számos módon. hogy ez a feltétel makroszkopikus rendszer, vagy a számos mikroszkopikus végre lehet hajtani. végrehajtja ezt macrostate. A definíció szerint a termodinamikai valószínűség W >> 1.
Például, ha a hajó 1 mól gáz, számos lehetséges módja N molekulák forgalomba két felét a hajó: ahol - Avogadro számát. Mindegyikük egy mikroállapot. Csak az egyik mikroállamok az esetben, ha az összes molekulák összegyűlnek egyik felében (például, jobbra) a hajó. Annak valószínűsége, hogy egy ilyen esemény szinte nulla. A legnagyobb számú mikroállamok megfelel az egyensúlyi állapotot, amelyben a molekulák egyenletesen oszlanak el a hangerő. Ezért az egyensúlyi állapot a legvalószínűbb. Másrészt egyensúlyi állapot olyan állapot maximális zavar a termodinamikai rendszer és az állam a maximális entrópia.
Boltzmann szerint entrópia S rendszer, és a termodinamikai valószínűsége W kapcsolódik az alábbiak szerint:
ahol k = 1,38 · 10 -23 J / K - Boltzmann állandó. Így, az entrópia határozza meg számának logaritmusával mikroállapot. Ezzel a macrostate is megvalósítható. Ezért entrópia lehet tekinteni, mint az intézkedés a valószínűsége az állam egy termodinamikai rendszer.
Valószínűségi értelmezést második törvény lehetővé teszi, hogy a spontán rendszer eltérést termodinamikai egyensúlyt. Ezek az eltérések az úgynevezett ingadozások. Azokban a rendszerekben, amelyek nagy számú részecske, jelentős eltérés az egyensúlyi állapot rendkívül kis valószínűségű.