termodinamikai paraméterek
Alapegyenletének MKT
Hőmérsékletet. abszolút hőmérséklet
Hőmérséklet kapcsolat az átlagos kinetikus energiája molekulák az anyag
Micro - makroparamétert és gáz halmazállapotban
Egy rendszer, amely egy nagyszámú molekula, az úgynevezett macrosystem. Macrosystem elválasztva a falak, a külső szervek állandó jellemzőkkel után hosszú ideig egyensúlyba kerül. Ez az állapot leírható számos paraméter, az úgynevezett állami paramétert. Megkülönböztetni microparameter és makroparamétert állapotban.
Azáltal mikroparamétert állapot lehet a következő fizikai mennyiségeket: tömeg M 0 molekulák, a sebességet, a rms molekulák sebessége, az átlagos kinetikus energiája molekulák, az átlagos idő közötti ütközések a molekulák, azok átlagos szabad úthossz, stb Ezek a paraméterek, amelyek tudható be egyet. makro molekula.
Makroparamétert állam csak jellemezni egyensúlyi rendszer egészére. Ezek közé tartozik a térfogata a nyomás P. T. V. Hőmérséklet sűrűsége , a koncentráció a belső energia U. N. elektromos, mágneses és optikai paramétereket. Az értékek ezen paraméterek segítségével lehet beállítani műszerek.
Molekuláris kinetikus elméletét ideális gáz megegyezik a mikroparamétert makroparamétert és a gáz.
Táblázat. Mikroparametry állam
Előállítás gázkeverő meghatározott tömegű vagy térfogatú
A alapegyenletének molekuláris kinetikus elméletét ideális gáz
Ez az egyenlet vonatkozik a rendszer makroparamétert - P nyomás és annak koncentrációja molekulS mikroparamétert - molekulatömeg, a közepes négyzetes sebesség vagy az átlagos kinetikus energia:
Ez az egyenlet azon a gondolaton alapul, hogy az ideális gázmolekulák engedelmeskedik a klasszikus mechanika törvényei, és a nyomás - az aránya az időben átlagolt erő, amellyel a molekulák sztrájk a falon, hogy a falfelület.
Az arányossági erő, amellyel a molekula téve a falon, a koncentráció, a tömeg és a sebesség az egyes molekula minőségileg érteni. A kvadratikus nyomásnövekedés ütemben összefügg azzal a ténnyel, hogy a sebesség nem csak attól külön táp-, hanem a gyakorisága molekuláris ütközések a falon.
Mivel a kapcsolat a molekulák koncentrációja a gáz és a sűrűsége ( = Nm 0) lehet beszerezni egy másik formája az alap egyenlet MKT ideális gáz:
Hőmérsékletet. abszolút hőmérséklet
Ábra. 2. Folyadék hőmérők
Az érintkező a két makro rendszereket, amelyek mindegyike egyensúly van, például, amikor kinyitja a csapot két hőszigetelt hajók gáz-, vagy kapcsolatba őket keresztül hővezető fal, az egyensúlyi van törve. Miután hosszú ideig részei az integrált rendszer, az új értékeket a rendszer paraméterek beállítása. Ha beszélünk csak a makroparamétert, akkor a hőmérséklet a testek.
A „hőmérséklet” vezették be a fizika, mint egy fizikai mennyiség jellemző mértékben a test nem melegszik a kísérletvezető szubjektív érzés, és az alapján objektív bizonyítéka fizikai eszközök.
Hőmérő - hőmérséklet mérőműszer, amelynek hatása alapul egy-az-egy csatlakozó rendszer a megfigyelt paraméter (nyomás, térfogat, a vezetőképesség, lumineszcencia fényerő, stb ...), hőmérséklet (2. ábra).
Úgy véljük, hogy ha ez a szekunder paraméter (például, a higany mennyisége a higany hőmérő) a hosszantartó kapcsolat alatt a test és egy hosszan tartó érintkezés másik testet az azonos, ez azt jelenti, hogy a hőmérséklet egyenlő a két szerv. Azokban a kísérletekben, hogy létrehozza a sebességeloszlás a molekulák kimutatták, hogy ez az eloszlás csak attól függ, a mértéke hő a test, mérve a hőmérő. A modern statisztikus fizika a természet, hogy az elosztórendszer részecske energia jellemzi annak hőmérsékletét.
A kalibráláshoz a hőmérő szükséges testhőmérséklet, amely akkor tekinthető állandó és reprodukálható. Jellemzően, ezt a hőmérsékleti egyensúlyt jeges - víz rendszer légköri nyomáson (0 ° C), és a víz forráspontja atmoszferikus nyomáson (100 ° C).
Az SI hőmérséklet kelvinben kifejezett (K). Ezen a skálán 0 ° C-on = 273,15 K és 100 ° C-on = 373,15 K. A mindennapi használatra, és más hőmérsékleti skála.

Egyenlet Mengyelejev - Clapeyron egyenlet (állapotegyenlet az ideális gáz)
Ennek eredményeként a kísérleti vizsgálatok számos tudós azt találtuk, hogy a makroparamétert reális gázok nem változtatható függetlenül. Ezek kapcsolatban az állam:
Ahol R = 8,31 J / (K · mol) - egyetemes gázállandó, ahol M - a gáz tömege és M - moláris tömege a gáz. Egyenlet Mengyelejev - Clapeyron nevezett állapotegyenlet. mert összeköti a funkcionális kapcsolat állapotát lehetőségeket. A rekord más formában:
Az állapotegyenlet, képes kifejezni egy paraméter a másik felett, és a telek első közülük, mint a második funkciót.
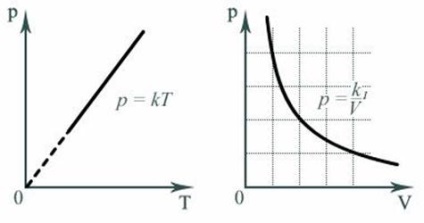
A grafikonok az egy paraméter egy másik, épített egy rögzített hőmérsékleten, térfogat és a nyomás, illetve az úgynevezett izoterma. Isochors és isobar.
Például, a P nyomás a hőmérséklet függvényében a T állandó térfogaton V. és állandó tömegű gáz M - egy olyan funkció, ahol K - konstans numerikus tényező. A grafikon egy ilyen függvény a koordinátákat P, T jelentése egyenes futó vonal a ered, mint a függvény grafikonját y (x) = kx az Y koordináták, x (3.).
A függőség nyomás P V a térfogat állandó tömegű gáz M és egy T hőmérséklet a következőképpen fejezhető ki:
,
Ahol K 1 - konstans numerikus tényező. A grafikonon az Y koordinátákat, x jelentése a hiperbola, valamint a grafikon a P, V koordináták.
Hőmérséklet kapcsolat az átlagos kinetikus energiája molekulák az anyag
A kvantitatív összefüggés van a a T hőmérséklet (macroparameter) rendszer, és az átlagos kinetikus energia (microparameter) ideális gáz molekula szerkezete megjósolható, ha összehasonlítjuk az alapvető egyenlet MKT ideális gáz állapotegyenlet és ahol J / K - Boltzmann állandó. Összehasonlítva a két kifejezést a nyomás, megkapjuk
Az átlagos kinetikus energiája egy ideális gáz molekulák arányos a gáz hőmérséklete. Ha a gáz molekulák vannak kialakítva két, három, és így tovább. G. atomok, ha bebizonyosodik, hogy ez a kifejezés csak kötődik az energia transzlációs mozgása a molekula egészének és a hőmérséklet.
Mivel ez az arány a mikro - és makroparamétert makró lehet mondani, hogy egy termikus egyensúly állapotába a két rendszer között van egy vonalban a hőmérséklet és az ideális gázok, az átlagos kinetikus energiája molekulák.