Meghatározása izobár izoterm potenciál (szabadentalpia)
magnézium-karbonát disszociációs szerint történik a reakció:
Annak megállapításához, a izobár izotermikusnak lehetséges, ki kell számolnunk az entalpia és az entrópia a reakció:
Entalpia rasschitvaetsya képlet szerint:
Izobár-izoterm potenciál (Gibbs energia) hőmérsékleten 298 K egyenlő:
Találunk izobár izotermikusnak potenciális hőmérséklet 350 0 C és 500 0 C,
650 0 C és 800 0 C-on
Kiszámoljuk az együtthatók egyenlet
Számítsuk entalpiája reakció hőmérsékleten 350 0 C (623 K) alapján az anyag általános képletű izobár hőkapacitása és Kirchhoff egyenlet:
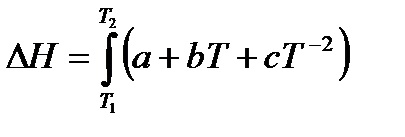
Abszolút entrópiája a reakció egy adott hőmérsékleten egyenlő:
Hasonlóképpen, számításokhoz hőmérsékleten 500 0 C (773 K), 650 0 C (923 K) és 800 0 C (1073 K).
Az eredményeket a 4. táblázatban mutatjuk be.
2.4 építése bemutatja a T értékét = f (# 8710; G)
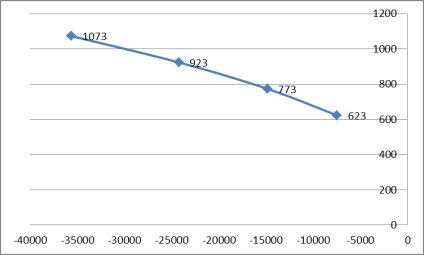
Ábra. 2. A grafikon a T = F (# 8710; G)
A reakció során befolyásolja a két tényező együttes hatásának: a tényező a változás az entalpia és az entrópia változik tényező.
Három lehetséges kombinációk:
1. A reakció irányába csökkenti a entalpia és entrópia növekedése. Ilyen esetben változtassa meg izobár izotermikus potenciál (szabadentalpia) sokkal kisebb, mint nulla. Az ilyen reakciók a gyors és irreverzíbilis szivárgást.
2. Az egyik tényező kedvező, a másik nem, és:
a) Változások a szabadentalpia negatív - reakció jelentkezik, de általában nem egészen az egyensúlyi állapotot;
b) A reakció változása nélkül szabadentalpia - ebben az esetben az a rendszer egyensúlyát;
c) Változás a Gibbs energia pozitívan - folyó visszaüt.
3. Mindkét tényező kedvezőtlen - ebben az esetben a változás a Gibbs energia sokkal nagyobb, mint nulla. Egy ilyen eljárás szerint tilos a törvényi termodinmiki.
Számítások hőmérsékleti adatokat eredményeket ad, amelyek alkalmasak az esetben a 2a.
Az E munka során meghatározásra került a levegő áramlási sebessége, a térfogata égéstermékek és a számított izobár-izoterm potenciál (Gibbs energia) hőmérsékleten 350, 500, 650, 800 0 C épített egy grafikon, a T = F (# 8710; G), amelyből egyértelműen azt mutatja, hogy a Gibbs energia változás negatív - reakció játszódik le, de mint általában, nem egészen az egyensúlyi állapotot.
Listája használt irodalom
1. DA Diomidovsky „kohászati kemence vaskohászatban” 1970;
3. VV Nashchokin "Műszaki termodinamika", 1975;
4. VN Zubarev "Workshop Műszaki termodinamika" 1986.