Kémia 10
7. alkotnak molekuláris képlete az anyag. Mivel a moláris tömege az anyag 2-szer magasabb a moláris tömege CH 2O, az indexek a képlet kell nőtt 2-szer:
(CH 2 O) · 2 = C 2H 4O 2.
A: molekuláris képlet Anyag - C 2 H 4 O 2.
Kérdések és feladatok
1. Mivel részek anyagok: a) súlyú 0,64 g réz; b) a víz tömege, 3,6 g; a) az Al 2 O 3 tömeg 51 g; d) glükóz-C 6 H 12 O 6 45 tömeg kémiai összegét, ezen anyagok mindegyikének, és az atomok számát bennük.
2. 0,54 g alumínium Súly teljesen reagáltatunk kén tömege 0,96 g reakcióterméket meghatározott képlet és nevezzük el.
3. A vegyület nitrogén hidrogénnel, a tömeghányad hidrogén 12,5%. Telepítése molekuláris képlete E vegyület, ha van egy relatív levegő sűrűsége 1,1.
4. kalcináljuk a kristályos szóda Na 2CO 3 · x H 2O tömege 5,72 g vízmentes szilárd anyag képződik tömege 2,12 g Határozzuk képletű eredeti kristályos.
5. A gázkeverék áll oxigén mennyiség (n. Y.) 4,48 dm 3, és a kén-oxid (IV) mennyiség (n. Y.) 6,72 dm 3. tömegének kiszámításához ezt a keveréket és annak relatív sűrűsége tekintetében hidrogénatom. Mi összeg (n. Y.) úgy állíthatjuk elő, a reakció az említett kéntartalmú-oxid-vegyületek (VI)?
6. A hőbomlás Egy anyag súlya 2,45 g alakult súlyú 1,49 g kálium-kloridot és a fejlődő oxigén térfogatát (n. Y.) 672 cm 3. Határozza meg a képlet az anyag.
7. teljes égés szerves anyag képződött tömegű 13,8 g szén-oxid (IV) tömegű 26,4 g és 16,2 g víz tömege megkeresése molekuláris képlete
anyagokat, ha a relatív sűrűsége gőzének hidrogén 23.

Atomi szerkezete és periodikus törvény
11. § Atomic Structure
Atom - a legkisebb növekménye egyszerű és komplex vegyületek. Szólva atomok, hangsúlyoztuk, hogy kémiailag oszthatatlan részecskék nem tűnnek el, vagy során fellépő kémiai reakciók.
Évszázadokon atom tekinthető egység, azaz. E. További oszthatatlan részecske. És csak a felfedezések által fizikus a XIX században, így erős bizonyíték, hogy bonyolult a szerkezete tartalmaz. Ezek a felfedezések elsősorban: a) a vizsgálat elektrolízis. . Azaz bomlási folyamatban anyagok áramütés .; b) megnyitása a katód sugarak - az áramlás a negatív töltésű részecskék, amelyek ezt követően nevezik elektronok; és végül c) a radioaktivitás detektálása. amely a spontán bomlása atomokkal egy elemét atomok más elemek.
A nukleáris modell atomszerkezetre
A XX század elején, kutatások alapján számos tudós, és mindenekelőtt, hogy megszerezzék a nukleáris neve az angol fizikus Ernest Rutherford állítottak idealizált modellje atomi szerkezete (bolygó). E modell szerint atom pozitív töltésű atommag körül mozog, és a negatív töltésű elektronok. Majdnem az egész tömeg a atom (több, mint 99,96%) koncentrálódik a sejtmagban. Core átmérője körülbelül 100, 000-szor kisebb, mint az átmérője a atom (nagyságrendileg 10 -8 cm).
Átmérő legnagyobb atom (Franciaország Fr) nagyobb, mint az átmérője a legkisebb (héliumatom Ő) több, mint 7-szer, a tömeg a nehéz (atomi elemet atomszámú 118) nagyobb, mint az a tömeg, a legkönnyebb (hidrogénatom) közel 300-szor.
A készítmény az atommagok
A modern elképzelések atommagok álló két típusú részecskék: protonok és a neutronok. a közös neve a nukleonok (a latin nucleus -. mag).
Protonok és neutronok lényegében azonos tömege kb 1u, t. E. Az egyik atomi tömegegység (lásd. 4. §). Proton (szimbóluma p) a töltés 1+, és neutron (szimbólum n) elektromosan semleges.
Az elektron töltése (szimbolikus jelölést e -) egyenlő 1-gyel, és a tömeg 1836-szer kisebb, mint az a tömeg egy proton. Ezért nyilvánvaló, hogy szinte az összes tömege egy atom koncentrálódik a sejtmagban.
A 4. táblázat mutatja a főbb jellemzői az elemi részecskék tartalmazó atom.
4. táblázat alapvető jellemzői elemi részecskéket tartalmaz az atom
Protonok és neutronok az atommagban tartanak különleges hatáskört, amelyek úgynevezett nukleáris erők. Nukleáris erők működnek csak nagyon rövid távolságokra (nagyságrendileg 10 -13 cm), de azok értéke a száz és ezer-szer nagyobb, mint a taszító erő, mint töltésű protonok. A kötési energiája a nukleonok a magok az atomok egy millió alkalommal az energia egy kémiai kötés.
Ezért, amikor a kémiai reakciók atommagok nem roncsolódnak, hanem csupán a átrendeződése atomok bekövetkezik.
A protonok száma (Z) a atommag nevezzük a proton számát. Ez megegyezik a rendszám az elem, és meghatározza a helyét a periódusos rendszerben. Ez a fizikai értelmében a rendszámmal. Az atomi száma határozza meg a helyét az elem a periódusos rendszerben, és ezért gyakran nevezik a sorozatszámot.

Atomi szerkezete és periodikus törvény
A töltés a mag határozza meg a protonok száma, és mint egész atom elektro-
semleges, akkor nyilvánvaló, hogy a több protont tartalmazó atom száma megegyezik az elektronok.
A teljes száma (N) a protonok (Z) és neutronok nevezzük a tömeg (vagy
nukleon) száma (A):
Mass szám határozza meg atom gyakorlatilag tömeg atomi egységek, mivel a tömege elektronok elhanyagolható része a teljes tömege az atom.
A töltés az atommag (proton szám), és a tömege számát jelzi, tiszta
lovymi indexek elhagyta a szimbólum egy kémiai elem A Z X. Például: July 14 N,
52 24 Kr. 92 235 U.
Megtekintése atomok bizonyos értékeit rendszámú és tömegszámú nevezzük nuklid.
Rövidítés használatos nuklidok elemneveket vagy szimbólumok jelezve a tömeg (nukleon) A: szén-12, vagy a 12 C, az oxigén-17, vagy a
17 O, 35-klór- vagy 35 Cl.
A legtöbb elemek formájában létezik több nuklidok, amelyek különböznek egymástól a tömegszáma. Ez annak a ténynek köszönhető, hogy a saját magoknak a protonok száma megegyezik lehet különböző számú neutront. Így egy természetes oxigén (Z = 18), kivéve a atomok a sejtmagban, amely
16 8 neutronok jelentése O, azt nuklidok neutron szám 9 és 10-17, és O
18 O. ilyen nuklidok a izotópok (a görög Izosov -. Egyenlő, toposz - pozíció), azaz „megszálló egy helyen” a periódusos rendszer ...
Az izotópok - nuklidokat azonos atomszáma, de különböző tömegszámú.
Más szóval, izotópok - ez nuklidjaival ugyanazon elem. Ezért az „izotóp” kifejezés csak akkor szabad használni, többes számban. Az izotópok minden elemének ténylegesen elfoglalni a helyét a periódusos rendszer
atomsúlya az elem átlagos tömege száma nuklidok tekintettel aránya az egyes természetes keverék. Ez magyarázza azt a tényt, hogy a relatív atomtömeg a többségi elem
zsaruk nem egész értékek.
Például a szén-létezik a természetben, mint a két nuklid - 12 C (a természetes aránya a keverékben egyenlő 0,9889) és 13 ° C (az aránya, amely egyenlő 0,0111). A relatív atomtömeg az ez az elem:
A r (C) = 0,9889 · 12 + 0,0111 · 13 = 12,011.
Minden nuklidok két csoportba sorolhatjuk: a stabil és radioaktív (rádió
nuklidok). Stabil nuklidok létezhet anélkül, hogy megváltoztatná az összetétele a nucleus végtelenségig. Ezért a legtöbb természetes nuklidok, amelyek részei az anyagok stabil körülöttünk.
A stabil állapot a atommagok megfelelnek bizonyos arányok a számok a protonok és a neutronok: könnyű elemek (atomi számokat 1-től 20) - Z / N ≈ 1 nehéz - körülbelül 0,6. Megsértése esetén a proton-neutron aránya mag (és vele együtt, és az atom) válik
A radioaktivitást az úgynevezett spontán átalakulását instabil magok a másik mag, kíséretében a kibocsátott különböző részecskék.
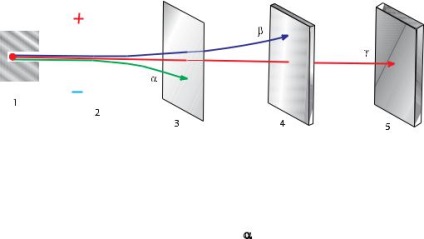
Ebben az esetben valójában ez -Átlagos elektronok termelt mag atom átalakításával egy proton, hogy egy neutron:
1 0 1 1 n → p + e -.
A radioaktív bomlás gyakran kíséri a kibocsátott gamma-sugarak - Hard fluxus-kvantum elektromágneses sugárzás nélkül töltés (lásd a 7. ábrát ..).
Stabilitás radionuklid jellemzi felezési T 1/2 - időtartam, amely alatt a magok száma miatt csökken a bomlásnak a felére.
A különböző radionuklidok, hogy mozog a másodperc tört része, hogy több milliárd évig. Így a 28 Al felezési ideje 2,2 perc, 131 I - 8 nap, 137 Cs - 30,17 év, a 238 U - majdnem 4,5 Gyr.
Felfedezése után a radioaktivitás az tette lehetővé, mesterséges transzmutációja egy kémiai elem egy másik, a szintézis a sejtmagok az elemek, amelyek nem léteznek a Földön. Így kaptuk a elemek találhatók a periódusos rendszer után urán U. Természetesen, az ilyen folyamatokat, bár az úgynevezett nukleáris reakciók, nem kémiai reakciókban, amelyekben az atomok nem tűnnek el, vagy ismét megjelenik.

Állam az elektron egy atom
A tanulmány a radioaktivitás vezetett a nukleáris energia fejlesztését, és sajnos a nukleáris fegyverek. A jelenség a radioaktivitás széles körben használják a tudomány, az orvostudomány, az ipar és a mezőgazdaság. Azonban voltak problémák a káros sugárzás élőlényekre az emberiségnek. Ezért a nukleáris folyamatok és radioaktív anyagok kell végezni szigorúan ellenőrzött körülmények között, megfelel a legszigorúbb biztonsági intézkedések.
Atom elektromosan semleges mikrorendszerének amely egy pozitív töltésű atommag és negatív töltésű elektronok.
Az atomi száma a kémiai elem képest a nukleáris feladata annak atomok, a protonok száma a sejtmagban, és az elektronok száma az atom.
Megtekintése atomok bizonyos értékeit rendszámú és tömegszámú nevezzük nuklid.
Radioaktivitás - spontán átalakulás instabil magok a másik mag, kíséretében a kibocsátott különböző részecskék.
Kérdések és feladatok
1. Milyen fizikai hatások is bizonyították, hogy bonyolult a szerkezete atom? Magyarázatot adnak minden.
2. Határozza meg a „proton szám”, „tömeges szám”.
3. Természetes réz keveréke a nuklidok 63 Cu és 65 Cu. aránya
természetes keverékének egyenlő 73%, a második - 27%. Számítsuk ki a relatív atomsúlya réz.
4. Mi a magtöltés neutronok száma, és az elektronok száma az atom egyes
A nuklid 35CI, 40 K, 56 Fe, 208 Pb?
5. Magyarázza az ok és a természet a radioaktivitás. Mi különbözteti meg a radionuklid stabil nuklid egyazon elem?
6. Határozza meg a szénatomok száma a C 5H 12 kémiailag mennyiségű 0,2 mól.
§ 12. állapota az elektron egy atom
A kémiai tulajdonságait az atomok csak akkor jelennek meg a kémiai reakciókban. Mivel a készítmény a atommagok nem változik, akkor nyilvánvaló, hogy bármilyen változás bekövetkezett a atomhoz a kémiai átalakítás, az eredménye, hogy megváltoztassa annak elektronikus állapotban.

Ábra. 8. ábra az elektron felhő egy atom hidrogén
Atomi szerkezete és periodikus törvény
A legtöbb tulajdonságait az atom határozza meg az elektronikus szerkezettel. Hogyan érinti a sajátos tulajdonságai az atom, az ingatlan az anyagok, amelynek részeként az atom, csak helyesen értelmezzük képviselő államok
az elektron egy atom.
Az alapot a modern elmélet atomi szerkezet törvények és rendeletek a kvantum mechanika hullám - a fióktelep a fizika, hogy tanulmányozza a mozgást mikroszkopikus tárgyak (elektronok, protonok, neutronok és más részecskék).
Szerint a kvantummechanikai ötletek mozgó elektron rejlő kettős természetű. Ez egy részecske (amelynek egy bizonyos tömeget, töltés), de a mozgás közel a nucleus van egy hullám jellegű (nincsenek meghatározott mozgáspályája, a pontos helyét a térben és mások.). Következésképpen, a mikro-objektumok, beleértve elektron, egyidejűleg rendelkezik a korpuszkuláris és a hullám tulajdonságokat.
Mivel mozgó elektron az atom hiányzik röppálya, annak érdekében, hogy leírja egy ilyen mozgás valószínűségi megközelítést alkalmazunk. Matematikailag meghatározott nem pontos helyzetét az elektron egy atom, és a valószínűsége annak jelenlétét egy adott területen perinukleáris térben.
State (kvantummechanikában szinonim mozgása) az elektron egy atom által leírt kvantummechanikai mód-
Do - elektron felhő (8. ábra). Az elektron mozog magjának közelében nagy sebességgel, ami negatív töltése, mintha „maszatos” az űrben. Kiderül, hogy a mag körül egy háromdimenziós elektron felhő. A sűrűsége az elektron felhő eltérő a különböző helyszíneken. Azokon a helyeken, ahol gyakran van egy elektron obrazuet-
kemping területén nagyobb elektronsűrűség.
Mivel van egy valószínűsége, hogy az elektron, még viszonylag nagy távolság a nucleus, az elektron felhő van bizonyos határokat. Ezért általában feltételes határoló felülete, amely mintegy 90% -a az elektron felhő. Ez a terület az úgynevezett perinuclearis teret atomi elektron orbitális vagy egyszerűen orbitális.

Ábra. 9. Driving s -electron pályák
Ábra. 10. reakcióvázlat p -electron pályák
Állam az elektron egy atom
Orbital - perinuclearis régióban a tér, amelyben megtalálják a legvalószínűbb az elektron.
Pályák, attól függően, hogy az elektron energia, hogy a különböző formájú és méretű. Ily módon egyetlen elektron orbitális a hidrogénatom egy gömb (golyó-szerű) alakú. ilyen
pályáknak egy gömb alakú, betű jelöli s. és az elektronok, hogy foglalják el ezeket pályák nevezik elektronok s-
Minél nagyobb az energia az elektron egy atom, annál kevésbé vonzza a mag, a nagyobb a mérete a orbitális (elektron felhő). Az elektronsűrűség növekedése a méret a pályák
Pályák a többelektronos atomok és lehet más alakú, mint például egy súlyzó alakú ( „bulk Nyolc”) (ábra. 10). Ezek a pályák betűvel jelöljük p. és az elektronok a nekik megfelelő, p- úgynevezett elektronokat.
A három p pályák vannak elrendezve (orientált) a perinukleáris térben mentén kölcsönösen merőleges mind a három tengely a koordináta-rendszer (11.).
Egy összetettebb formában d-típusú pályák és F-típusú.
Ábra. 11. A relatív helyzetét p pályák egy többelektronos atom
Atomi szerkezete és periodikus törvény
Bemutatunk orbitális sejtek (kvantum sejt), és az elektron - formájában nyilak. Így, az orbitális a hidrogénatom annak egyetlen elektron lehet az alábbi képlettel ábrázolható:
További mozgás a mag körül, az egyes jellemző, egy pillanatra az elektron mozgás, amely az úgynevezett spin. Egyszerűsített centrifugálás (angol spin -. Forgás) is képviselteti magát, mint egy elektron forgása saját tengelye körül. A spin az elektron csak akkor lehet forgatni az óramutató járásával megegyező vagy azzal ellentétes irányban. Egy orbitális nem lehet több,
két elektron, amelynek egymással ellentétes (antiparallel) vissza.
Ebben az esetben a két elektron nevezik páros:
Egy ilyen állapotban egy atom energetikailag kedvező. Ellentétben az azonos spin-állam:
Ha az egyik elektron pályák is, hogy páratlan.
Az elektronok egy atom különböznek az energia. Minél nagyobb az energia az elektron az atom, az távolabb van a sejtmagban, következésképpen annál nagyobb a mérete az elektron felhő (orbitális). Ezzel szemben, az elektronok, amelyeknek viszonylag alacsony energia az idő nagy részében, közel a nucleus, árnyékolás (szűrés) más elektronok, amelyek vonzzák a sejtmagba gyengébbek és távolabb is. Így alakult ki, mint egy héj elektronok közel a energia értékeket. Azt lehet mondani, hogy az elektronok közel a energia értékek alkotják egyetlen elektron az atom,
Throne réteget. vagy az energia szintet.
Az energia szinten (elektron réteg, az elektron héj) - egy sor elektronok energiákkal közelében értékekkel.
A száma energiaszint egy atomot, amelyen van elektronok egyenlő az időszaknak a számát, amely egy kémiai elem
KÖZ a periódusos rendszerben. Minden energia szintje számával jelölünk: n = 1, 2, 3, 4. ∞. Minél nagyobb a szint száma, annál nagyobb a