Hogyan számoljuk ki a sok kommunikáció kémia
Kémia tanul módon szubatomi részecskék kölcsönhatásba lépnek egymással alkotó atomok. Kémia is vizsgálja folyamatok atomok a vegyület molekulájához. Belül atom elektronok a mag körül vannak elrendezve az úgynevezett elektron pályák. Mindegyik orbitális héj elhelyezésére egy bizonyos mennyiségű elektront. Amikor a következő borítékot teljesen megtelik, új elektronokat kezd kialakulni, a következő, távolabb a mag burkolat, és mégis teljesen ki legyen töltve. Így az elektronok új héj a mag körül; nehezebb atom, a több elektront és elektronhéjak van. Amikor két atom egymáshoz a molekulában, azok az elektronok kölcsönhatásba egymással beágyazásával be nincs teljesen kitöltve elektron héj szomszédos atomhoz. Mivel abban az esetben, kialakítva ezzel egy egységes elektron héj egy atom a molekulában először megtöltjük a következő rendelkezésre álló orbitális, és a folyamat folytatódik, amelybe több távoli betöltésére. A cikk elolvasása után, akkor megtanulják, hogyan kell kiszámítani a sok kémiai kötés.
lépések szerkesztése
1. módszer a 2:
Határozza kötés és antibonding pályák szerkesztése

Nézd meg a diagramot az elektronikus orbitális kagyló. Ezek a diagramok vannak megadva a tankönyvek, kézikönyvek kémia. Mint látható, az egyes héj bizonyos távolságban az atommag. Mivel minden zárt rendszer hajlamos állapotban minimális energia (a tulajdonság ismert néven entrópia), az elektronok hajlamosak kitölti mind alacsonyabb orbitális héj lehetséges.
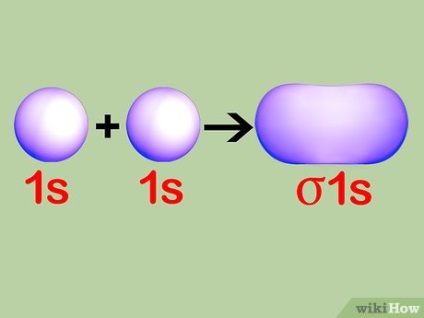

A koncepció a kötés pályák. Amikor két atom hajlamosak létrehozni egy olyan molekula, igyekeznek használni egymás elektronok töltse ki az alsó szintű szabad saját orbitális kagyló. Szerint a töltési fok a orbitális kagyló minden atom lehet meghatározni, hogy hány szomszédos atom elektronok állapotban a magasabb energia kitölti a szabad helyet a belek a második alacsony energiájú atomok. Ezek a pályák nevezett kötőanyagok.
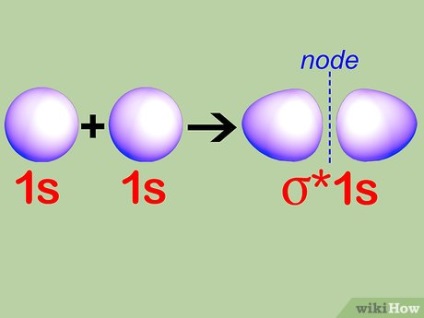

A koncepció a antibonding pályák. Amikor két atomokkal együtt a molekula cseréje elektronok, néhány elektronok kell kényszerült, hogy a magasabb energia orbitális az, mert az összes alacsony energiájú állapotok már ki van töltve. Ezek pályák nevezzük antibonding pályák.
2. módszer 2:
Megtalálni a sok közlemény jogok
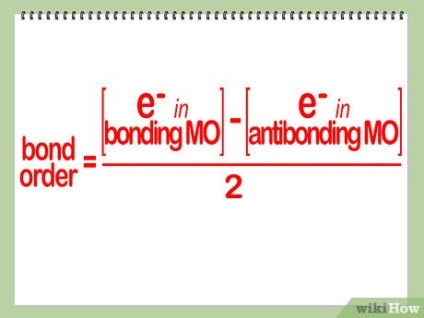

Határozzuk meg az energia állam a képződött kémiai vegyület. Minden elektron helyeztük orbitális kötő molekulák hozzá fog járulni a megerősítését a molekuláris kötés. Fordítva, minden elektron található a antibonding pályák, akkor destabilizálja a molekulában. Adjuk meg egy új energia állapotban, elosztjuk 2 az összeg közötti különbség, a kötőanyagok és szétesést elősegítő elektronok (vagyis elektronok van a megfelelő pályák).


Talált energiájú állapot és multiplicitással kapcsolatban a molekula. Ha a sok kapcsolat nulla, egy ilyen molekula nem alakítható. Minél nagyobb a multiplicitása kommunikáció, annál stabilabb a molekula.
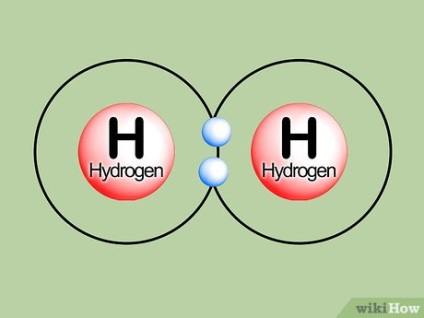

Tekintsünk egy egyszerű példát. Hidrogénatom semleges állapotban van egy elektron elrendezve s héj. Ez shell fér két elektront. Amikor két hidrogénatom vannak összekötve, az egyes biztosít az elektron, hogy töltse ki a héj második atom, és ennek eredményeként képződnek két kötődő orbitális. Az elektronok nem kell váltani magasabb elektronpályára következő p shell, úgy, hogy a antibonding pályák vannak kialakítva. Így, a sok kommunikáció egyenlő (2-0) / 2 vagy 1. A formákat ismert molekula hidrogéngáz H2.