A multiplicitás kommunikációs - Referencia vegyész 21
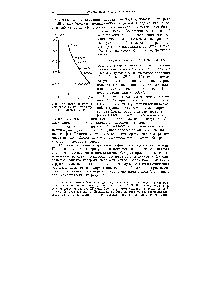
Ábra. 168- Effect kommunikációs multiplicitás (n) a internukleáris de távolságban
Többszörös kötések. Eddig nézett molekulák egyszeres kötés. t. e. a molekulának csak egy kötés. Azonban, egy sokkal változatosabb molekulák és komplex ionok. átlagos multiplicitás (sorrendben), amelyben a kapcsolat nagyobb, mint egy. A kommunikáció javítása sokaságának kötelesek a cikk I- kötés és b kötvények. Például, egy molekulában N2, amelynek hármas kötést [c.77]
Ismertesse az elektronikus molekulák szerkezete a CO és SH a helyzetét a Nap és MO módszerek. Mely jellemzett molekulákból nagyobb sokfélesége kommunikációs [c.61]
Összehasonlítás multiplicitás kapcsolatok és a mágneses tulajdonságok és molekuláris Rs ioia molekula E 2. [c.61]
2. példa összehasonlítása mágneses tulajdonságainak multiplicitás és F kötések a molekulában, és a ion p2. Egy nagy kötési energia a részecskék küldik elektronikus állításokat. [C.60]
Ennek alapján a frekvenciákat a vegyérték rezgés. tudjuk számítani a erőállandók. Az utóbbi függ a jellegétől kötésű atomjai és a sok kapcsolat (fülre. 14). [C.146]
Többszörös kapcsolat ilyen esetekben leírható a következő általános képletű [c.164]
A multiplicitás csatlakozások rendre - -2-jód kötési energiája E1, hogy E jelentése nagyobb, mint F a molekulában,. [C.60]
Aetod MO lehetővé teszi, hogy meghatározza egy úgynevezett eljárás, vagy sokasága kommunikációs fele az elektronok száma a svyazyvayu- [č.58]
Rövid összefoglaló figyelembe véve a legegyszerűbb képviselői alkánok. alkén és alkin. A növekvő kommunikáció sokfélesége növeli a teljes erejét, lerövidítve a távolságot a C-C. Azonban, mivel a jelenléte N-etilén és acetilén kötvények különböznek etán kémiai labilitás. És ezzel egyidejűleg a változó a C-H kötést ezek a vegyületek. SYH módszer, amely társítható egy változás a természetben a hibridizáció szénatom orbitálok ebben a sorozatban (SP etán és etilén SP SP acetilén) annak hosszának csökkentésével, a szilárdságot növeljük, úgy a képességét, hogy protonálás. Jellemzői kötvények táblázat mutatja. 9. [c.110]
Elektronikus szerkezetét N2 molekula tartották a Sec. 2.5. I-Link között a nitrogénatomok (szemben a szén) és erősebb kötések (ua ábra. 3,43 vonal E, attól függően, hogy a sok kommunikáció szén-szén kötések le van hajtva, és a nitrogén-nitrogén kötések a le-, hogy okozott nagyobb, mint szén atommag töltés N. az képződését csak egy mag, és a kommunikáció [c.394]
Tekintettel a sok CH kötés 1 s, .H = 0,5-1 0,5-1 + 1 = [c.171]
Az elfogadott kémiai representations vegyértéke atom lehet meghatározni, mint az összege multiplicitásának kötések által kialakított azok az atomok. Ezután a következő képlet segítségével (65), tudjuk írni [c.170]
Különbségek a csatlakozások multiplicitással CHCH = CH-CH = CH, [c.174]
A kötés hossza atomok között a 2. és 3. kevesebb 1,54A megnövekedett elektron sűrűsége a kapcsolat, hogy van egy bizonyos multiplicitással. A multiplicitás Ezzel kapcsolatban megtalálható butadién grafikusan (ábra. 42), ismerve a sokfélesége kapcsolatok és a szolgálati idő a különböző szénhidrogének [c.112]
Általában a kötési energiát két adott atom függ multiplicitása kommunikációs és a módszer a telítési más atomok ezen vegyértékkel, m. E. A sorrendben, amellyel atomok vagy atomcsoportok vannak társítva. A növekvő multiplicitás - az átmenetet egy egyszerű kapcsolatot egy dupla és egy hármas kötés - mindig erősen kötődő energiája nő. De egy adott multiplicitással kisebb különbségek csatlakoztatási módszereket, telítettség más vegyértéke az atomok sokkal gyengén befolyásolja a vizsgált kötési energiát. [C.84]
A sok kommunikáció. A multiplicitás kommunikációs bevezetése miatt a kötés n- és 6 kapcsolatokat. Például, egy molekulában, imeyushih, hogy hármas kötést [c.71]
Rasstiyanie között a szénatomok között növekvő multiplicitással Csökkenti a kommunikációs-shaets1 és célszerűen 0,1543 0,1353 és 0,1205 nm. [C.77]
A könyv átfogó és könnyen érthető, és ami a legfontosabb, módszertanilag korrekt bevezeti az elmélet a kémiai kötés és az eredmények alkalmazása a leírást a szerkezete és tulajdonságai vegyületek különböző osztályok. Első bemutatott pre-kvantum ötletek J. Lewis vegyértékű (Lewis ovyh) struktúrák és azt mutatja, hogy már a alapján képviseletet szocializációja elektron pár és egy egyszerű oktett szabály használatával logikus érvelés a nagyszámú kapcsolatok és hivatalos vádemelés nélkül is lehetséges, bonyolult matematikai számításokat, mint mondják az ujjakon. hogy ismertesse a szerkezete és tulajdonságai sok molekula. Lényegében ez kezdődik Bevezetés a modern kémia áthatja a véleményét, és a feltételeket a két fő megközelítés, hogy a kvantum elmélet kémiai szerkezete, a módszer a vegyértékkötéseket (BC). Sajnos, annak ellenére, hogy az egyszerűség és intuitív vonzereje ezeket a gondolatokat, és az eljárás a nap nagyon bonyolult számítási és nem teszi lehetővé minőségileg megoldani a kérdést, hogy az energia az elektronikus államok a molekulákat. amely nélkül lehetetlen megítélni körülbelül szerkezetüket. Ezért, az alábbiakban a kvantumelmélet a kémiai kötés kerül bemutatásra elsősorban keretében eltérő megközelítést-módszer molekulapálya (MO). A példában kétatomos molekulák a belépett kulcs ábrázolása MO elmélete orbitális átfedés és az energia szintje MO, kötelező jellegüket és a nyirokcsomó tulajdonságait. valamint az MO szimmetria. Mindez építési végződik általános diagramok MO és Homonukleáris kétatomos molekulák Goethe -royadernyh vita és az ő segítségükkel a szerkezete és tulajdonságai számos egyedi rendszerek egyszerre világossá válik, hogy bizonyos tulajdonságait molekulák (például mágneses) magyarázható csak az alapján a kvantumelmélet MO. Következő MO elmélet alkalmazzák poliatomos molekulákat. és bizonyos esetekben ez történik szempontjából lokalizált MO (hasonló az ötlet az irányt a Nap kapcsolatokat módszer) és a tervezési vezetünk hibridizáció atomi pályák. míg mások kénytelenek a delokalizált MO. Megbeszélés E kérdések végződik érdekes írásbeli szakasza a lehetőségeit a molekuláris spektroszkópia, hogy meghatározzuk a vegyületek szerkezetét a leírásban ismertetjük elveit rezgési spektroszkópia [C.6]
Általános kémia a képletekben, definíciók, rendszerek (0) - [c.57. c.70]
Általános kémia a képletekben, definíciók, rendszerek (1985) - [c.57. c.70]
Általános kémia a képletekben, definíciók, rendszerek (0) - [c.57. c.70]
Elméleti alapjai Organic Chemistry (1973) - [c.140]