Fizikai tulajdonságai a hidrogén
Hidrogén H - kémiai elem, az egyik leggyakoribb az Univerzumunkban. tömegű hidrogén elemként a anyagösszetétel 75% -a a teljes tartalom atomok más típusú. Ő belép a legfontosabb és alapvető kapcsolat a bolygó - a víz. A megkülönböztető jellemzője hidrogén is tény, hogy ő az első elem a periódusos a kémiai elemek D. I. Mendeleeva.

Felfedezés és kutatás
Az első említés a hidrogén írásaiban Paracelsus nyúlnak vissza a tizenhatodik században. De az izolálás gáz és levegő keverékének a tűzveszélyes tulajdonságai kutatást végeztünk a tizenhetedik században a tudósok Lemaire. Hidrogén alaposan tanulmányozták angol kémikus és fizikus tudós Henry Cavendish, amely empirikusan bizonyította, hogy a tömeg a hidrogén legalacsonyabb összehasonlítva más gázokat. A későbbi szakaszában a fejlődés a tudomány, sok tudós dolgozott vele, mint a Lavoisier, aki ezt „generált víz.”
Jellemző a helyzetet PSKHE
Element, megnyitva a periódusos D. I. Mendeleeva - jelentése hidrogénatom. Fizikai és kémiai tulajdonságai az atom mutatnak bizonyos kettősség, mivel a hidrogén egyidejűleg tartozik az első csoport, a fő alcsoportja, ha úgy viselkedik, mint egy fém, és ad egy elektron a folyamat kémiai reakció és a hetedik - abban az esetben, teljesen kitöltve vegyérték héj, vagyis a vételi negatív részecskék, amely jellemzi, mint a hasonló, mint a halogén.

Jellemzői az elektronikus szerkezet az elem
A tulajdonságok a hidrogénatom komplex anyagok, amelyhez hozzá van benne, és egy egyszerű anyag a H2 elsősorban határozza meg az elektronikus konfigurációja hidrogénatom. A részecske elektron Z = (-1), amely forgatja a pályáján a mag körül, amely egy protont egy tömegegységére, és a pozitív töltés (+1). Elektronikus konfiguráció 1s 1. rögzített mivel az mutatja a jelenlétét negatív részecske önmagában az első és egyetlen hidrogén s-pályák.
Amikor elkülönítési vagy a visszarúgás elektron és egy atom az elem az a tulajdonsága, hogy egyesíti fémekkel kapott kation. Lényegében hidrogénion - pozitív elemi részecske. Ezért, az elektron mentes hidrogén úgynevezett egyszerűen egy proton.
fizikai tulajdonságok
Röviden leírt hidrogén-fizikai tulajdonságai, színtelen, gyengén oldható gáz relatív atomi tömege 2, 14,5-szer könnyebb, mint a levegő, a cseppfolyósító hőmérséklet -252,8 Celsius fok.
A kísérletben, akkor könnyen meg a H2 a legegyszerűbb. Ez elegendő ahhoz, hogy kitöltse a három golyót különböző anyagok - a hidrogén, szén-dioxid, jellemzően levegő -, és egyidejűleg engedje őket a kezét. A leggyorsabb, hogy elérje a földet, amely tele van a CO2. ezt követően cseppek levegő befúvatásával tartalmazó keverék H2 és az összes okot, hogy a felső határ.
Egy kis súly és méret a részecskék hidrogén igazolja azt a képességét, hogy áthatoljon a különböző anyagok. A példa azonos labdát ebben könnyű, hogy egy pár nappal azután, hogy leereszt magát egyszerűen gáz halad át a gumi. Továbbá, a hidrogén felhalmozódhat a szerkezet bizonyos fémek (palládium vagy platina), és amikor a hőmérséklet emelkedik, hogy elpárologjon belőle.
Tulajdonság hidrogén takarékosan a laboratóriumban használt, az izolálási módszer vízkiszorítás. Fizikai tulajdonságai a hidrogén (táblázat szemlélteti tartalmazza az alapvető paramétereket) határozza meg annak alkalmazási körét és előállítási módszer.
Paraméter atomok vagy molekulák az egyszerű anyag
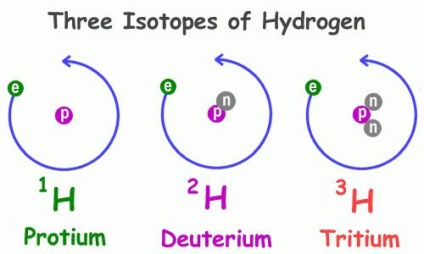
Az izotóp-összetétel
Mint sok más tagjai a periódusos rendszer a kémiai elemek, hidrogén számos természetes izotópok, azaz atomok a protonok száma megegyezik a sejtmagban, de különböző számú neutronok - részecskék nulla és egység töltés tömeg. Példák atomok, amelyeknek hasonló tulajdonság - az oxigén, a szén, a klór, bróm és hasonlók, beleértve a radioaktív.
Fizikai tulajdonságai a hidrogén 1 H, a legelterjedtebb a képviselői ennek a csoportnak lényegesen eltérnek a jellemzőit társaitól. Különösen a különböző funkciók az anyagok, amelyhez tartoznak. Így, van egy szabályos és a deuterált tartalmazó víz az összetételében helyett hidrogénatom csak egy protont deutérium 2 H - izotóp két elemi részecskék: pozitív és töltetlen. Ez izotóp két alkalommal nehezebb, mint általában a hidrogén, ami megmagyarázza az alapvető különbség a tulajdonságok a vegyületek, amelyek alkotnak. A természet a deutérium található 3200-szer ritkább, mint a hidrogén. Harmadik Jellemző - trícium, 3H, a fő, hogy két proton és egy neutron.
Előállítására szolgáló eljárások és izolálására
Laboratóriumi és ipari előállítására szolgáló eljárások hidrogén egészen más. Így, kis mennyiségű gáz keletkezik elsősorban a reakciót, amely ásványi anyagokat, és a nagyüzemi termelés az egyre szerves szintézissel.
A következő kémiai reakciókat alkalmazunk a laboratóriumban:
- Reakciói alkáli- és alkáliföldfémek, vízzel reagáltatjuk, alkáli- és a kívánt gázzal.
- A elektrolízise egy vizes elektrolit oldatot, az anód áll H2 ↑, és a katód - oxigén.
- Bővítése alkálifém-hidridek a vizes, lúgos, és a termékeket rendre, gáz H2 ↑.
- Reagáló híg savval a fémekkel, sókat és H2 ↑.
- Az akció alkáli szilícium, alumínium és cink is hozzájárul, hogy a kibocsátás a hidrogén párhuzamosan a komplex sók.

Az ipari gázok által szerzett haszon olyan technikákkal, mint:
- Termikus bomlás metán jelenlétében egy katalizátor, hogy az azt alkotó elemi anyagok (350 fok értéket eléri az ilyen paraméter például a hőmérséklet) - hidrogénatom, H 2 és szén C. ↑
- Átviteli vízgőz át a koksz 1000 Celsius fok alkotnak CO2 és H2 ↑ a szén-dioxid (a leggyakoribb módszer).
- Conversion metángáz a nikkel-katalizátor-ig terjedő hőmérsékleten 800 fok.
- Hidrogén mellékterméke az elektrolízis során a vizes oldatokat kálium-klorid vagy a nátrium.
Kémiai kölcsönhatások: általános rendelkezések
Fizikai tulajdonságai a hidrogén nagyrészt magyarázza annak viselkedését válaszként folyamatok egy adott vegyület. Vegyértéke hidrogén 1, mivel ez található a periódusos az első csoport, és mutat egy másik oxidációs állapotba. Az összes vegyületet, azzal az eltéréssel, hidridek, hidrogén-sd = (1+), a molekulák, mint például CN, XH2. HN3 - (1).
Egy molekula, hidrogéngáz, alakítják ki, hogy generalizált elektronpár, tagjai két atom és meglehetősen stabil energetikailag, emiatt normál körülmények között több inert a reakció és belép normál feltételek megváltoznak. Attól függően, hogy az oxidáció mértékét a hidrogén, mint más anyagok, ez szolgál mind egy oxidálószert és egy redukálószert tartalmaz.
Olyan anyagok, amelyek reagálnak hidrogén és
Elemental interakció alkotnak egy összetett anyagok (gyakran magasabb hőmérsékletet):
- Az alkáli- és alkáliföldfém-+ H = hidridet.
- Halogén + H2 = hidrogén-halogenid.
- Kén + = hidrogén-szulfid.
- Oxigén + H2 = víz.
- Carbon + H = metán.
- Nitrogén + H2 = ammónia.
Kölcsönhatás összetett anyagok:
- Előállítása szintézis gáz szén-monoxid és hidrogén.
- Recovery származó fémek oxidjaik H2.
- Hidrogén telítettsége telítetlen alifás szénhidrogének.
hidrogénkötés
Fizikai tulajdonságai a hidrogén olyanok, hogy lehetővé teszik, hogy kapcsolatban egy elektronegatív elemmel, így egy speciális típusú kapcsolatot azonos atom a szomszédos molekulák osztatlan elektronpár (például oxigén-, nitrogén- és fluoratom). A legtisztább példa, hogy egy jobban szemügyre ezt a jelenséget - ez a víz. Azt lehet mondani, varrott hidrogénkötések gyengébb, mint a kovalens vagy ionos, hanem annak a ténynek köszönhető, hogy sokan közülük jelentős befolyást gyakorol az anyagok tulajdonságait. Tény, hidrogénkötés - a elektrosztatikus kölcsönhatás, amely megköti vízmolekulák dimerek és polimerek, bizonyítva a magas forráspontú.
A hidrogén az összetétel ásványi vegyületek
A kompozíció a szervetlen savak közé tartozik a proton - kation atom, például hidrogén. Anyag-maradékot, amelynek oxidációs foka nagyobb, mint (-1) van az említett több-bázisú vegyületet. Jelenleg több hidrogénatom, ami a többfokozatú disszociációs vizes oldatokban. Minden ezt követő proton-maradék elválik nehezebb. Ahhoz, hogy mennyiségileg hidrogén tartalma a környezetben határozza meg a savasság.

Hidrogén amely hidroxilcsoportokat és bázisok. Ezek kapcsolódnak a hidrogénatom az oxigén, ami az oxidáció mértékét a maradék alkáli mindig megegyezik (-1). A tartalmi hidroxilcsoportok környezetben által meghatározott bázicitása.
A használat az emberi tevékenység
Henger egy anyag, valamint a konténerek más cseppfolyósított gázok, mint az oxigén, van egy konkrét megjelenését. Úgy festett darkish-zöld színű, élénk piros „hidrogén” betűkkel. Gázt injektálunk a ballon nyomáson körülbelül 150 atmoszféra nyomáson. Fizikai tulajdonságai a hidrogén, különösen könnyű gáznemű halmazállapot és használják azok kitöltésére keverékével hélium ballonok, hangzású léggömbök, stb
Hidrogén, a fizikai és kémiai tulajdonságait, amelyek az emberek megtanulták használni sok évvel ezelőtt, abban a pillanatban részt számos iparágban. Fő tömege megy a termelés az ammónia. Hidrogénatom is részt vesz a termelés a fémek (hafnium, germánium, gallium, szilícium, molibdén, volfrám, cirkónium, és mások) az oxidok, beszél a reakció, mint redukálószer és egy sót hidrogén-cianidot, metil-alkohol, valamint szintetikus folyékony tüzelőanyag. Az élelmiszeripar használja fel, hogy átalakítani a növényi olajok szilárd zsírok.
Meghatározott kémiai tulajdonságai és a hidrogén alkalmazása különböző hidrogénezési folyamatok és hidrogénezése zsírok, szén, szénhidrogének, olajok és nehéz fűtőolaj. Vele termelnek drágaköveket, izzó, kiad kovácsolás és hegesztés fém termékek hatása alatt az oxigén-hidrogén láng.

12 dolog, amit nem szabad vásárolni használt Lásd a listát azokról a dolgokról, hogy mindig friss, és soha nem vásárolni őket másodkézből.
