Eoiaiiia ae aoaiaeoi Aiea
4.1. kovalens kötés
Ha figyelembe vesszük a természet a kovalens kötés már használják két megközelítés: A módszer vegyértékkötéseket (MBC), és az eljárás a molekulapályák (IMO).
Az MFR Feltételezzük, hogy a kommunikációs hajtják az atomok között a teljes területen elektron pár mindkét magban. Képeznek egy pár elektronok miatt lehetséges, hogy az átfedés a elektron felhők ellentétes spin.
Megkülönböztetése csere és donor-akceptor mechanizmusa kovalens kötés kialakulását.
1) A csere mechanizmus. Mindegyik atomot ad egy párosítatlan elektront a teljes elektronpár:
2) A donor-akceptor mechanizmus. Egy atom (donor) biztosít egy elektronpár, és a többi atom (akceptor) előírja a pár szabad orbitális;
Két atom lehet szocializálódnak neckolko elektronpár. A számú elektron pár, két atomot összekötő nevezzük multiplicitása kapcsolat ilyen szénatomok között. Egyszerű (rendes) kapcsolat megfelel egy közös elektronpár, kettős vagy hármas kötés - rendre két vagy három közös elektronpár.
Ha az elektronsűrűség található szimmetrikusan az atomok között, a kovalens kötés az úgynevezett nem poláros. Ha az elektronsűrűség irányába van eltolva az egyik atom, a kovalens kötés az úgynevezett poláris. Minél nagyobb a polaritás a kapcsolat, annál nagyobb a különbség a electronegativities atomok.
Elektronegativitás - az a képesség, egy atom, hogy vonzzák elektronokat más atomok sűrűsége. A leginkább negatív töltésű elemek - fluor, a legtöbb töltésű - Franciaország.
A kovalens kötés van irányított, telíthetőségével és polarizálhatóságot.
Telítettség következik abból a tényből, hogy a kovalenciá az atom nem lehet tetszőlegesen nagy. Ez határozza meg a számát párosítatlan elektronok a vegyérték shell, közel hozzájuk az energia az elektronok a nem megosztott elektronpár és üres pályák.
Irányhatás kovalens kötés szükséglet határozza meg a maximális átfedés a térben az elektron felhők a kölcsönható atomok, ami a kialakulását a legerősebb kötvények.
Attól függően, hogy a geometria a átfedés az elektron felhők atomi pályák megkülönböztetni Sigma, és delta pi -bond. Sigma -bond van kialakítva, ha az elektron felhők maximális átfedés összekötő egyenes a központok az atomok (összekötő tengely link). Ez képezi egy kötés a molekulában két N al - miatt az átfedés a elektron az atomok a két s-elektronok (CIGMA s - s-kötés). A molekula HCI Sigma -bond van kialakítva átfedő s -electron felhők hidrogénatom és p elektron klóratom (s -p Sigma -bond), és a kétatomos halogén-molekulákat - átfedése miatt elektron felhő p-halogén atomok (Sigma P p-kötés).
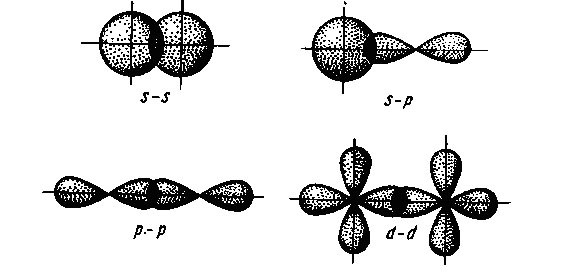
A átfedése atomi pályák kialakulását szigma -kötéseken
Abban az esetben, pi-kötések maximális átfedési elektron felhők végezzük két területen, szimmetrikusan elrendezett két oldalán a link. Például, egy nitrogén-molekulát, valamint egy szigma -bond, két pi-kötések eredő átfedés elektron felhők más p-elektronok (Pi rr - kötés).
Ha a kép egy egyszerű kapcsolat, akkor mindig van egy szigma-kötés, ha a sok fenti linkek egyik atomok közötti kötés - szigma - és mások - pi-kötés.
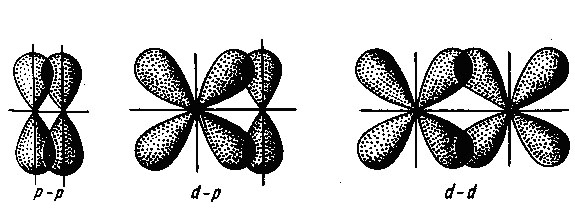
A átfedése atomi pályák a kialakulása egy pi-kötés
Delta-kötés alakul átlapoló d pályák mind a négy szirmok.
A átfedési foka elektron felhők kialakulását a kommunikáció függ a szimmetria és a relatív orientációban. Így, az esetben, ha kölcsönös átfedés Sigma -bond s - és p felhők kialakulásához vezet egy erős kötés, hanem a két egymást átfedő s -oblakov. Még tartósabb kötést eredményeként keletkezik az átfedés a két p pályák kialakításához szigma -kötéseken. Ez annak a ténynek köszönhető, hogy a p-felhők felett kiterjesztették, hogy nagyobb átfedést. Mindazonáltal, abban az esetben, átfedő pi-kötések előfordul, hogy kisebb mértékben, mivel ez végzik oldalsó részek alatt és felett a kommunikációs vonal, ahol a pi-kötés kevésbé tartós, mint a szigma -bond.
Irányhatás kovalens kötés meghatározza a geometria a molekulák, azaz kölcsönös elrendezése az atomok és a szögek közötti kötések.
Amikor a kialakítási A kötés pályák különböző formájú és teljesítmény a hibridizáció, azaz, igazítás a forma és az energia. Feltételezzük, hogy ennek eredményeként a átfedő több különböző pályák képződik azonos számú, azonos hibrid pályák.
Hibrid pályák különböző alakja a kiindulási értékhez képest: amerre meghosszabbodnak egyik irányba, és így azok átfedési foka az elektrondonor az atomok, amellyel kommunikációs képződik, a fenti. Ennek eredményeként ez az átfedés a energia nyereség.
Szerint a kezdeti száma megkülönböztetni pályák SP -, SP 2 -, sp3 hibridizációs.
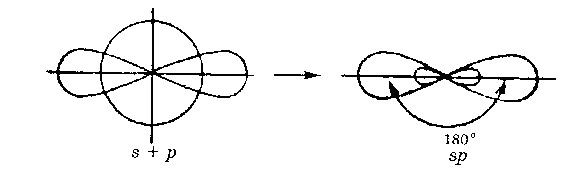
SP hibridizáció. Egy orbitális S- és P egy orbitális átalakítható két azonos „hibrid” pályák, a bezárt szög a tengelyek egyenlő 180 °.
Két SP- pályák képezhet két s -bond (Beh 2. ZnCI2). Két. - kapcsolat is kialakítható, amikor az elektronok (acetilén C 2 H 2) két p- orbitálok nem vesznek részt a hibridizációs.
Molekulák, amelyekben az SP-hibridizáció, lineáris geometria.
SP 2 - hibridizáció. Egy orbitális S- és p- pályák két átalakul három azonos „hibrid” pályák, a bezárt szög a tengelyek egyenlő 120 °.
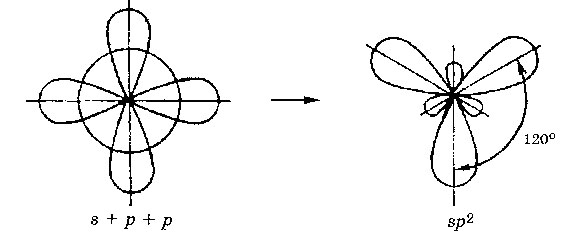
Ha a kötés által kialakított átfedése pályák összekötő vonaltól az atommagba, ez az úgynevezett s - kötést. Ha az orbitális átfedés kívül összekötő vonal a mag van kialakítva - a kapcsolat. A három SP 2 - pályák alkothat három s - csatlakozó (BF al 3. AICI3). Egy másik kommunikációs (-? Bond) képződhetnek, ha a p-pályák nem vesznek részt a hibridizációs, ez egy elektron (etilén C 2 H 4).
Molekulák, amelyekben az SP 2 - hibridizáció, van egy planáris geometriát.
sp3 - hibridizáció. Egy orbitális S- és p- pályák három alakítjuk négy azonos „hibrid” pályák, a bezárt szög a tengelyek egyenlő 109 ° 28”.
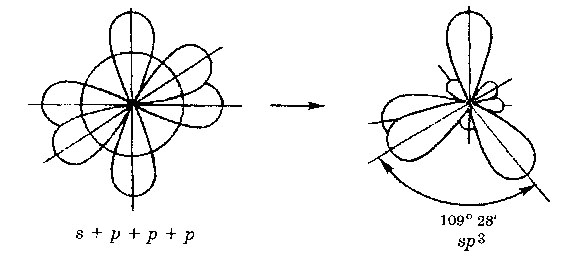
Molekulák, amelyekben az SP 3 - hibridizáció, van egy tetraéderes alakú (CH 4 NH 3).