Elektrolitok és nemelektrolitok
Az elektrolitok olyan anyagok, lebomló ionokra oldatban, és ezért villamosan vezető. Ras pad elektrolitok ionokra, amikor vízben feloldjuk, a hívások Xia elektrolitos disszociáció. Az intézkedés alapján egy áram-elektriches ionok megszerezni irányított mozgás: pozitív-negatív töltésű ionok elmozdulni a katód, és az úgynevezett catty-onok (
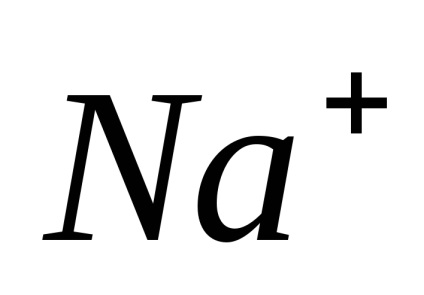
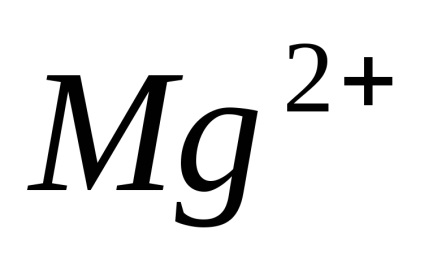
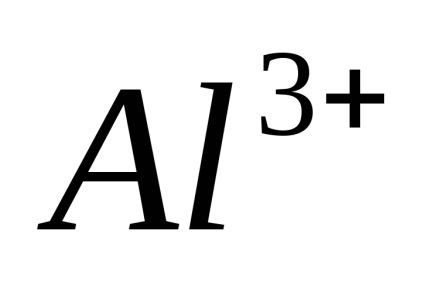
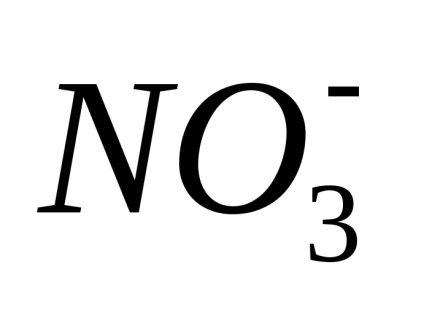
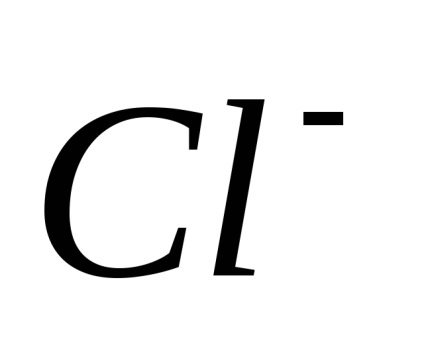
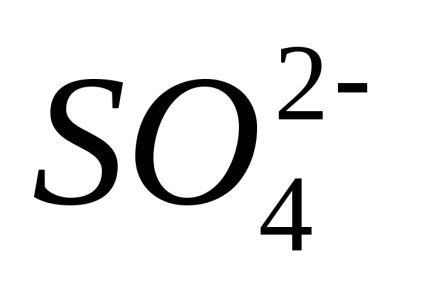
Disszociáció - megfordítható folyamat, azaz, párhuzamosan a bomlási molekulák folyamat lezajlik vegyületet ionokat ionokra (disszociációs) (Association). Ezért az egyenleteket elektron-troliticheskoy disszociációs helyett az egyenlőségjel fel a jele reverzibilitásra.
Anyagok nem bomlanak oldatban ionokra, és nem elektromos áram vezetésére, úgynevezett nem-elektrolitok (olaj, benzin, kerozin, fűtőolaj, alkohol, cukoroldat, stb).
Szerint a disszociációfok megkülönböztetni az erős és gyenge elektrolitok. Az értékek a disszociációs mértéke bizonyos elektrolitok táblázatban mutatjuk be. 3 alkalmazásokhoz. A disszociációfok

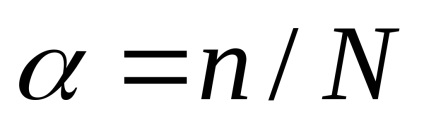
A disszociációs mértéke, empirikusan határozzuk meg az ólom-rank elektrolit vezetőképessége, és van kifejezve frakciói egységek vagy százalékban. Például, ha



Attól függően, hogy a disszociációfok összes villamos-trolity vannak osztva erős (



PH, vagy az oldat pH.
Kémiailag tiszta víz egy gyenge elektrolit és egy nagyon kis része a molekulák disszociál ionokra:
Szerint a tömeghatás törvénye egyensúlyi állandója vizet egyidejűleg határozzuk meg, és a disszociációs állandó-niem expresszió:
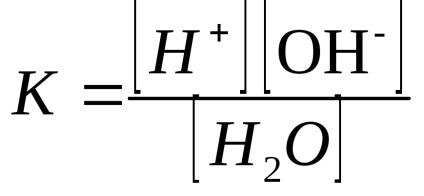
A hőmérséklet 25 ° C-on a disszociációs állandója a víz körülbelül
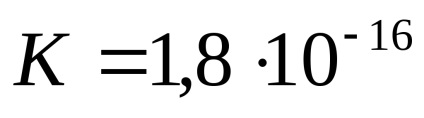
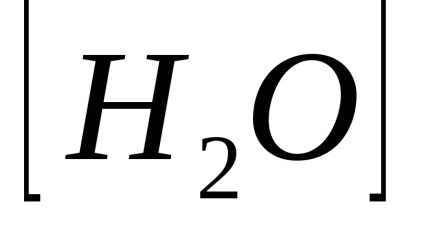
A víz és a híg oldatokat a termék a hidrogénionok koncentrációját és a hidroxid anionok egy állandó oka ólom nevezett ion termék vízben
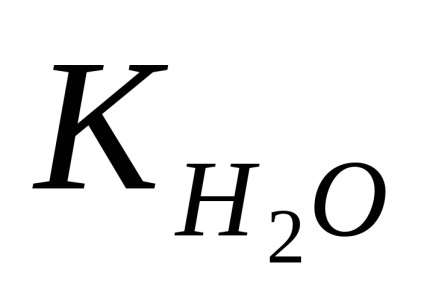
A tiszta víz és semleges oldatok feküdjön 25 ° C-on:
A savas oldatokban felett hidrogénionok koncentrációját és lúgos -
koncentrációja hidroxid aniont; termék
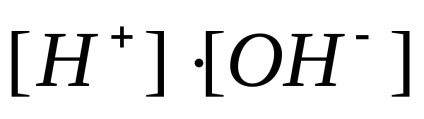
Savas és bázikus tulajdonságait elektrolitok általában mennyiségével jellemezve hidrogén-ion koncentráció. Annak elkerülése érdekében, használata negatív kitevők, hogy az említett koncentráció kifejezése, ez általánosan expresszált átnyomódó hidrogénatom index, jelöljük szimbólum pH. Hidrogén-index - logaritmusát con-központosítás hidrogén ionok, figyelembe az ellenkező megjelölés:
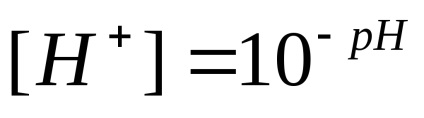
A pHharakter környezetben is képviselteti magát az alábbiak szerint:
pH = 7 - semleges környezetben; pH <7 – кислая среда; рН> 7 - lúgos környezetben.
mutatók meghatározásához használt reakcióközeg. Indikátorok - speciális reagensek, hogy változtatni a színét függően hidrogénionok koncentrációját. Pro-mezhutok a két pH-érték, ami változik a az indikátor színe, az úgynevezett intervallum átmenet az indikátor színe. A közelítő becslés az oldat pH-ja adhat egy univerzális in-vissza- jelzõ. Egy pontosabb értékét a pH alkalmazásával határozzuk meg pH-mérő eszköz.
A pH az egyik fontos jellemzője ive korrozív környezetben, és függ a tartalma a vízben oldott gázok:
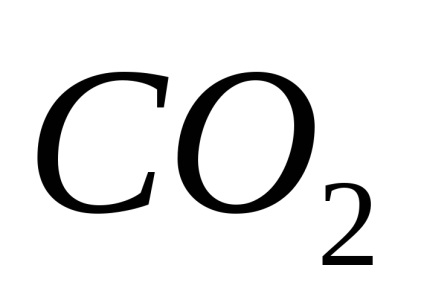
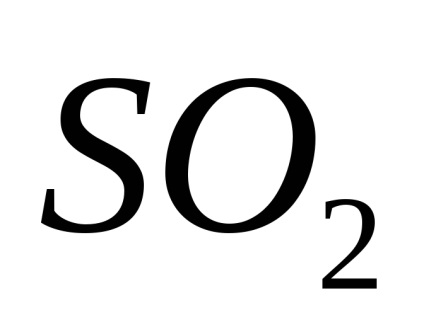
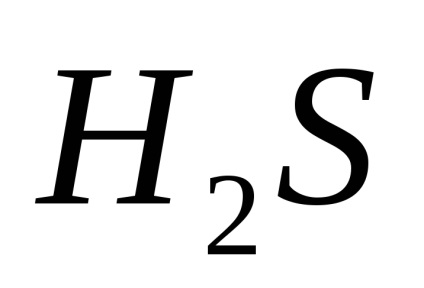
és a közeg savas lesz (pH =<7).
A pH-értéket befolyásoló, és néhány só, amely hidrolízist vízben.