Az izolálás módja, termesztés és vírusok azonosítását - studopediya
Laboratóriumi issledovaniyapri hordozó vírusok azonosítására és diagnosztizálására vírusfertőzések a következő lépéseket tartalmazza: izolálás, tenyésztés, a jelzés (azonosító), és a vírusok azonosítását.
2.3.1 termesztése vírusok
A vírusok nem szaporodnak mesterséges média, és szaporodnak csak a sejten belül. Jelentős eredmény volt a javaslat R. Gudpaschura 1932 termesztésére használt vírusok csirke embriók. A végső döntést a termesztés vírusok probléma csak úgy volt lehetséges, ha az alapvetõ módszereit sejtek tenyésztésével a testen kívül fejlesztettek ki.
Használata csirke embriók. Csirke embriók - szinte ideális modellek, amelyek nem a termesztés vírusok (például influenza és kanyaró). A zárt üreg megakadályozza embrió-kilenced mikroorganizmusok behatolt kívülről, valamint a fejlesztés a spontán vírusfertőzések. Az embriókat használjuk a primer vírusizolálás kórbonctani anyag; A passirova-CIÓ és mentése, valamint, hogy a szükséges mennyiségű vírus. Néhány excitaton-beépítése (pl herpeszvírusok) okozhatnak jellegzetes változások (lehet őket használni Detection kádba betegség).
A fertőzéshez általában használ csirke embriókat 7-12 napos. Mielőtt a kihívás, életképességét az embrió keresztül lámpázást (néző áteső fényben). Élő embriók során Lámpázás mutató lokomotoros aktivitást, jól látható vaszkuláris mintázat. Egyszerű ceruza megszabja a határokat a légkamra.
Csirke embriók beoltott vírus-tartalmú anyag aszeptikus körülmények között steril eszközökkel, előkezelést a héj a légtér jóddal és az alkohol. Fertőzés végezzük a chorio-allantois membrán, a magzatvíz vagy allantoin üregben, vagy peteburkában (29. ábra). A módszer megválasztása függ a fertőzés biológiai tulajdonságainak a vírus.
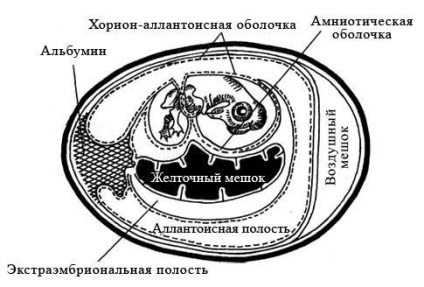
29. ábra - sematikus rajza-feszültsége a fejlődő csirkeembrió
Sejttenyésztés. Kezdetben volt az eljárás túlélő szövetet. Feküdt az a tény, hogy a lombik tartalmazó tápoldatban hozott egy darab ronggyal. A sejteket bizonyos szövetek ilyen körülmények között képes túlélni a kád (de nem reprodukálható) legfeljebb 30 napig, és a vírus szaporodni őket. Azonban ez a módszer termelt nagyon alacsony vírus hozammal. Erre azért volt szükség, hogy fejlesszék a feltétel lenne szabad reprodukálni, amely szöveti sejtek.
Mert sejtkultúrák req-Dimo megoldani négy fő probléma:
- a kívánt mennyiségű a szabad (azaz, izolált egymástól ..) sejteket;
- arra, hogy olyan táptalaj és a feltételeket, amelyek mellett a sejtek aktívan szaporodnak;
- biztosítja, hogy a feltételek, amelyek sejttenyészetek nem fajta baktérium;
- azonosítani a módszereket, amelyekkel felismerni a növekedés a vírus sejttenyészetben, és azonosítani.
Ahhoz, hogy elszigetelni (elválasztva), de az életképes sejtek a sérült szövet kezdték használni feldolgozása egy gyenge megoldást a tripszin-bontó intercelluláris hidak pontos. Sejttenyésztés a különböző média javasoltak már, amely tartalmazza az összes szükséges sejt multiplikáció tápanyagok (aminosavak, bázisok, vitaminok, stb), az ásványi sók, amelynek optimális pH stb G. Ekkor a táptalajhoz hozzáadott indikátora, amely színváltozás lehet megítélni sejtanyagcsere és megsokszorozódik-SRI. Azt találtuk, hogy, mint egy alapot, amelyre sejtek szaporodása és a forma egy egyrétegű jól használható kezelt üveg teszt csövek és kémcsövek. Hogy elnyomja a lehetséges baktériumok növekedését a vírus-tartalmú anyag a vetés előtt, hogy a sejttenyészet GRAIN Steel Pipeline antibiotikumok.
1949-ben, George. Enders, T. Weller és Frederick Robbins azt mutatta, hogy a poliovírus szaporodik jól elsődleges tripszinizáljuk sejttenyészetekben majomvesébõl származik. A fő hátránya az elsődleges tripszinezzük sejtek abban a tényben rejlik, hogy miután néhány részeket azokat már szaporodnak. Ezért előnyben kezdte élvezni a kultúra ilyen sejtek, amelyek képesek szaporodni in vitro végtelenségig. Az ilyen átültetett sejttenyészetek (sejtvonalak jellemzi halhatatlanságot és heteroploid kariotípus) nyert daganatos szövet (HeLa származó nyaki karcinóma, HEp-2 - a gége karcinóma; Detroit-6 - a metasztázis tüdőrák a csontvelő; RH - vesetumor ember) vagy a mutáns sejtek poliploid kromoszómák. Azonban a tumorsejtek nem lehet használni a vakcinák előállítására. Ezekre a célokra csak azok sejttenyészeteket alkalmazunk, amelyek nem tartalmaznak vírusokat és kontaminantnyh nincs rosszindulatú. A legjobb, hogy megfeleljen ezeknek a követelményeknek diploid sejtekben.
Poluperevivaemye (diploid) sejttenyészet - a sejtekben az egy genotípus, amely képes in vitro ellenállnak 50-100 passzálással, miközben az eredeti diploid kromoszómák. Diploid humán embrionális fibroblaszt vonalakat használunk mind diagnosztizálására vírusfertőzések és a termelés virális vakcinák. Mint kiderült, a vírusokat lehet nem csak tenyésztett sejtekben, amely egy egyrétegű az üvegcsövön, de egy élő sejt szuszpenziót.
A megélhetés táptalajok szükség tenyésztett sejtekben. Előzetes megbeszélés alapján, ők osztják a növekedés és a támogatást. A növekedési tápközeg kell tartalmaznia több tápanyagot, amelyek aktív sejtek proliferációjának és kialakulását egy egyrétegű. Támogatása környezetek élményt már a sejt monoréteg képződött tenyésztése során egy vírus.
2.3.2 Vírusizolálás
Vírusizolálás sejttenyészetekben. Elosztása során a vírusok különböző fertőző anyagok (vér, vizelet, nyálka mentesítés, tamponok a szervek) használt sejttenyészet, amelyek a legnagyobb érzékenység a tervezett vírus. A fertőzéshez tenyészeteit használva kémcsövekbe egy jól fejlett egy sejtréteg. A fertőzés előtt a táptalajt eltávolítottuk, és a sejteket az egyes csövekben készült 0,1-0,2 ml szuszpenzió az anyag előkezelt antibiotikumok, hogy megöli a baktériumokat és gombákat. 30-60 perc múlva az érintkezési a vírus a sejt monoréteg a felesleges anyagot eltávolítja vezetünk a tenyészetbe fenntartó tápközeget, és a mintát hagyjuk a kemencében, amíg a jelek a vírus replikáció.
Vírusizolálás laboratóriumi állatokban. Ha lehetetlen izolálni és azonosítani a vírus in vitro standard módszerekkel fertőző anyagot beadjuk fogékony állatok a kórokozó, és miután a fejlesztés a tipikus fertőző járunk újrafertőződés érzékeny sejttenyészetek. A legtöbb gyakran egerekben, nyulakban, és a majmok; kiemelni néhány vírus (mint például a Coxsackie vírus) fertőzik szopós egerekben. Mivel a magas költségek és a komplexitás a labor állat, szinte mindenhol helyükre került ragasztó-pontos kultúrát. Az állati modellek tanulmányozása aktívan, különösen stey patogenézisében és kialakulása immunválaszt a vírusos fertőzések.
Így izolálása tiszta tenyészeteinek vírusok in vitro következő élő objektumok jelenleg használatban (biológiai modell): 1) sejttenyészet (szövetekben, szervekben); 2) csirke embrió; 3) laboratóriumi állatok.
2.3.3 jelzése vírusok
Jelzése a vírus csirke embrió. Jelzése a vírus csirkeembrió által termelt embrionális halál pozitív haemagglutináció-üveg allantois vagy magzatvízben a kialakulását a fokális elváltozások ( „plakkok”) a chorio-allantois membrán.
Jelzése vírusok sejtekben. Mutatója az a vírus a fertőzött sejttenyészetekben lehet:
1) A fejlesztés a specifikus sejt-degeneráció - a vírusos citopatikus hatását (CPE), három fő típusa van: nagy- vagy kissejtes degeneráció; képződését többmagvú óriássejtek (symplast); fejlesztése sejtproliferatív elváltozások, amely több sejtréteg (acinussejtek degeneráció).
Két módszer sejthalál vírusok által okozott - nekrózis és apoptózis. Nekrózis miatt előfordul, hogy visszafordíthatatlan károsodása sejtmembrán integritásának, apoptózis - nukleáris DNS-fragmentáció hatása miatti celluláris endonukleáz.
Sejtkárosító effektyotsenivayut mikroszkópos sejttenyészetekben. Mértéke szerint a sejt károsodása izolált vírusok magas vagy közepes citopatikus:
2) kimutatása intracelluláris zárványok. elrendezve a citoplazmában és / vagy a magok a fertőzött sejtek;
3) a pozitív hemagglutináció reakció (WGA) vagy gemadsorbtsii (RGAds). Egyes vírusok, mint például az influenza vírus, van egy különleges recept-készlet (hemagglutinin), amelyek révén adszorbeált vörösvértestek és okozhatja a agglutinációs (hemagglutináció). Az ilyen vírusok könnyen detektálható hemagglutináció vagy gemadsorbtsii (eritrociták adszorbeálódott a vírus-fertőzött sejtek cul-túrák szövetek);
4) jelenség lepedéket. Elterjedt javasolt 1952-ben R. Dulbecco plakk vizsgálattal (negatív telepeket), hogy lehetővé teszi a mennyiségi vírusok. A vírusizolálás egysejtrétegben eltávolítása után táptalajt oltottunk be, vírust tartalmazó anyagot és bevonva egy réteg agar tartalmazó semleges vörös indikátor. Csészék (fiolák) inkubáltunk 37 ° C-on Miután 48-96 óra észlelt foltok - lepedéket. Nekik van egy 1-3 mm átmérőjű, és úgy tűnik festetlen egy rózsaszín háttér. A foltok miatt sejtkárosító hatása a vírus;
5) színreakció Salk. A növekedés a vírus a sejtekben lehet megítélni a mutató által hozzáadjuk a táptalajhoz. Ha a sejtek aktív anyagcserét, a pH eltolódik a savas oldalon, és a közeg sárgává válik. Abban az esetben, szaporítása vírus sejtek elpusztulnak, a pH kicsit változik, és megtartja az eredeti (magenta) szín, vagy (semleges pH-n) válik narancs;
6) reakció interferencia (használt hiányában a CPE, hemagglutinációs és gemadsorbtsii) tanulmányozták a tenyészet fertőzött vírussal többször okozva CPE. Pozitív esetben CPD lesz jelen (interferencia reakció pozitív). Ha a vizsgálati anyag a vírus nem volt megfigyelhető CPP.
Ezen túlmenően, kimutatására különböző vírus-szerológiai vizsgálatok is használható sejttenyészetekben.
Jelzése vírusok laboratóriumi állatokban. Jelzés kimutatásán alapulnak a vírus állatok tüneteit fertőző betegség, regisztráció haláluk, a tanulmány a természet patológia és kórszövettani elváltozások a szövetekben és a szervekben, azonosító pozitív hemagglutináció.
2.3.4 azonosítására szolgáló módszerek vírusok
Meghatározása a vírus típusától (azonosító) alapul biológiai aktivitásának semlegesítése a vírus-sti használó típus-specifikus antiszérummal. A végeredmény lehet beállítani alapján az alábbi szolgáltatásokat:
1) semlegesítése citopatikus hatás. tartalmazó tápközegben vizsgált virus, így kereskedelmi szérum (például rubeólavírus gyanúja IT), inkubáljuk, és fertőz egy második tenyésztési; 1-2 napon belül közölheti citopatogén vírus. A jelenlétében a citopátiás hatás következtetni, hogy az első tenyészetet vírussal fertőzött, megfelelnek az antitestek használatával szérumok;
2) a reakcióelegyet semlegesítjük gemadsorbtsii;
3) megváltoztatja a kijelző színét a minta;
4) a késleltetést (fékezés) a hemagglutináció reakciót. vegyes tenyészet közegben egy holding-kórokozó egy ismert kereskedelmi antiszérum és hozzájárulnak a sejttenyészethez. Az inkubáció után, a képesség a kultúra hemagglutinációban, és annak hiánya teszi a következtetést nem felelés a vírus antiszérummal.
5) semlegesítés állatkísérletekben.
Így RN (semlegesítési reakció) alapján a elnyomás a megfelelő reakciókban, a jelenség a fertőző folyamat, miután egy tenyészet, vagy állatoknak való adagolására keverékével vírus-SPE fichnymi AT, tartalmazta a diagnosztikai szérumban.
Kérdések az önuralmat
1 Mik az alapelvek a vírus besorolás.
A 2. ábra a magyar és latin nevét a fő családok vírusok az emberek és állatok.
3. Melyek a tipikus képviselői nagy családok és vírusok által okozott betegségek őket.
4. Melyek a jellemzői a morfológiai és ultrastruktúráját emberi és állati vírusok (fő családja)?
5 Név genomiális RNS-t és genomi DNS-t növényi vírusok.
6. Milyen lépések közé tartozik a laboratóriumi vizsgálatok a vírusok azonosítását, és a diagnózis vírusfertőzés?
7. Melyek a biológiai modell izolálására használt és termesztése az emberi és állati vírus?
8. Milyen a fertőzés csirke embriók laboratóriumi?
9. Melyek a módszerek megszerzésének sejttenyészet, tudod?
10 Hogyan elvégzi a vírus azonosítása csirke embriók és a laboratóriumi állatok?
11. Melyek a vírusok megjelenítési módszerek sejttenyészetben?
12. Mi a célja és jellege a semlegesítés reakciók vírusok?
13. Milyen módon lehet semlegesíteni a vírusokat beállítás reakciókat.