Arrhenius-egyenlet
Arrhenius-egyenlet. aktiválási energia
Átalakítása a prekurzor részecskék a reakciótermékek, általában együtt járó legyőzése potenciálgát, amely az úgynevezett aktivációs energia egy kémiai reakció (E).
A jelenléte a potenciális akadályt annak a ténynek köszönhető, hogy minden egyes részecske (molekula, csoport ion) - többé-kevésbé energetikailag stabil képződését. A szerkezetátalakítási a reagáló fajok igényel törés vagy gyengülése egyes kémiai kötések, a szükségességét, hogy fordítsuk az energia. Aránya részecskék energia nagyobb, mint E jelentése E - E / RT (Boltzmann törvény). A kémiai átalakulás során csak azok a részecskék, amelyeknek az energia nagyobb, mint E, így a sebességi állandó reaktsiik
e - E / RT. Ez az első alkalom zavisimostkot T Arrhenius származó kísérleti adatok. Azt a formát
Ez a képlet két paraméter: az aktiválási energia E és pre-exponenciális faktor (pre-exponenciális faktor) A. aktiválási energia a minimális többlet energia, amely a részecskék (vagy egy pár reagáló részecskék) lép kémiai reakciók. Exponent e - E / RT jelentése a frakció aktív részecskék vagy aktív részecskék ütközése eredményeként reaktsii.Predeksponentu Amozhno tekinteni, mint egy állandó sebesség, amellyel az aktív faj reagálnak. Amint az könnyen látható, k = A, E = 0 IK AAmikor → T → ∞.
Arrhenius törvény levezethető az elmélet termodinamikai kémiai egyensúly az alábbi feltételezések:
1) való transzformációt termékek molekulák megelőzi a átmenetet egy aktív módosítást, amely előírja a energiaráfordítás E;
2) ezt a hatóanyag-molekulák Aakt módosítás van kialakítva egy reverzibilis folyamat: A ↔ Aakt.
Kakt = [A] ACT / [A]; ahol valahogy - az egyensúlyi állandó;
3) A hatóanyag koncentrációja molekulák módosulat nagyon kicsi, úgy, hogy azok képződése gyakorlatilag nem változik a koncentráció a kiindulási molekulák, azonban Aakt Kakt = [A];
4) az aktív módosítása alakítjuk a végtermék olyan sebességgel, amely független a hőmérséklet, azaz a kémiai reakció sebességi állandója
mivel szerint termodinamika, dlnKakt / dT = + E / RT 2.
dlnk / dT = d lnKakt / dT = E / RT 2 vagy
LNK = - (E / RT) + const.
Elhelyezés const = LNA, ahol A - egy állandó, függetlenül a hőmérséklet, van
LNK = lnA- (E / RT) ilik = Ae - E / RT.
Ebből a következtetést, egyértelmű feltételeket, amelyek mellett egy egyszerű kémiai reakció következik az Arrhenius törvényt. Először is, aktiválása molekulák csak akkor következik be, mivel a hőenergia. Ha a molekulák által gerjesztett fény töltött részecskék, stb Az Arrhenius törvényt nem lehet végrehajtani. Másodszor, az áramlás a reakció ne zavarják az egyensúlyi az energia eloszlása a szabadsági fok a reagáló részecskék (2. feltétel).
A függőség a reakció sebessége a hőmérséklet néha kifejezett hőmérsékleti együtthatója. A hőmérsékleti együttható α (T) azt mutatja, hogy hány alkalommal a vegyi reakciók arányát növekszik a hőmérséklet emelkedésével a 10 K:
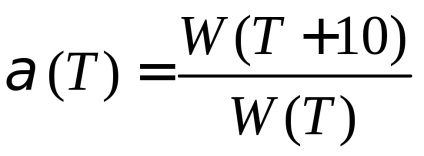
Néhány elemi reakciók, például rekombináció az atomok, ionok és gyökök, E
