Amint csatlakozik tartalmaznak a molekulában
Atom - a legkisebb stabil (a legtöbb esetben) részecske anyag. Molekula is nevezik néhány atom kapcsolódik össze. Ezt a molekulát tárolt maga információt a tulajdonságait egy adott anyag.
Atomok a molekula különböző típusú kommunikáció. Ezek különböznek irányba és az energia, amely segítségével létre ezt a kapcsolatot.
A kvantum-mechanikai modellje a kovalens kötés
A kovalens kötés révén van kialakítva, a vegyérték elektronok. Amikor két atom átfedés van az elektron felhők. Az elektronok minden egyes atom mozogni kezd egy olyan területen, amelyek egy másik atom. A tér körül őket, van egy felesleges negatív potenciál, amely húzza a pozitív töltésű atommag. Ez csak akkor lehetséges, feltéve, hogy a teljes elektron spin antiparalel (irányított különböző irányokba).
A kovalens kötés jellemzi egy meglehetősen nagy kötési energia atomonként (körülbelül 5 eV). Ez azt jelenti, hogy úgy 10 eV két atom a molekula által alkotott kovalens kötés tört. Az atomok kerülhetünk közelebb egymáshoz a szigorúan meghatározott állapot. Ezzel a konvergencia figyelhető meg átfedés az elektron felhők. Pauli-elv kimondja, hogy nagyjából azonos atom nem lehet forgatni a két elektron ugyanabban az állapotban. Minél több átfedés van, annál több az atomok taszítják egymást.
hidrogénkötés
Ez egy speciális esete a kovalens kötés. Ez alkotja két hidrogénatom. Ez egy példa erre kémiai elem a húszas a múlt század, kimutatták a mechanizmus a kovalens kötés kialakulását. A hidrogénatom nagyon egyszerű a szerkezete, amely lehetővé tette a kutatók pontosan megoldja a Schrödinger egyenlet.
ionos kötéssel
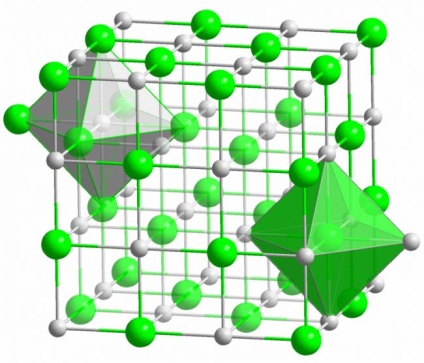
Crystal összes ismert képezett só segítségével ionos kötés. Ez akkor fordul elő, amikor a alkotó atomok a molekula, van egy nagy különbség a elektronegativitása. Kevésbé elektronegatív atom (abban az esetben, a kristály só nátrium) elküldi az összes vegyérték elektronok klór-, egyre egy pozitív töltésű ion. Klór, viszont lesz egy negatív töltésű ion. Ezek az ionok vannak kötve a szerkezet egy elektrosztatikus kölcsönhatás, amelyet az jellemez, egy meglehetősen nagy erővel. Ezért az ionos kötés erőssége a legmagasabb (10 eV atomonként, amely két-szer nagyobb, mint az energia egy kovalens kötés).
Az ionos kristályok ritkán figyelhető hibák különféle. Elektrosztatikus kölcsönhatás szilárdan tartja a pozitív és negatív ionok bizonyos helyeken, így úgy tűnik üresedés ofinterno- dal és egyéb hibák a kristályrács.