Általános képletek szénhidrogének Chemistry
Definíció és általános képletű szénhidrogének
Szénhidrogének - olyan szerves vegyületek, amelyek molekulái áll atomjai két elem - a szén és hidrogén.
A szénhidrogének kifejezés kiterjedt csoportja szerves vegyületek. Azonban csak egyetlen egy - metán - tartalmaz szénatomot tartalmaz, a többi állnak ragasztott szénatomokkai együtt kezdve két (etán, etilén, acetilén) és befejezve a több százezer nagy molekulatömegű szénhidrogének.
Összhangban a szerkezet a szénváz a szénhidrogén vannak osztva alifás (nyílt láncú) és ciklikus (zárt láncú szénhidrogén).
Attól függően, hogy milyen típusú kötést képez a szénatomok között az alifás telített szénhidrogének vannak osztva. , amelyek csak S-kötést és telítetlen. egyaránt tartalmazó s- és p-kommunikáció. A telített szénhidrogének tartoznak alkánok. Telítetlen szénhidrogének, jellegétől függően a többszörös kötést vannak osztva alkén (kettős kötés), és alkinek (hármas kötés). Ezen kívül, külön csoportokat megkülönböztetni a kettős kötések száma a molekulában, mint például a alkadiének (két kettős kötést).
Alkánok úgynevezett telített szénhidrogéneket, amelynek molekulái állnak szén- és hidrogénatomokból kapcsolódnak össze egyetlen s-kötések.
Alkének nevezzük telítetlen szénhidrogéneket, amely molekulák egy kettős kötést tartalmazhat.
Az általános képlet a homológ sor alkének CnH2n. Képviselői alkének: etilén- (C2 H4), propén (C3 H6), butén (C4 H8), és mások.
Alkadiének az úgynevezett telítetlen szénhidrogéneket, amely molekulák tartalmazhatnak két kettős kötést. Az általános képlet a homológ sorozat alkadiének CnH2n-2. Képviselői alkadiének: propadién-1,2 (C3 H4), butadién-1,4 (C4 H6), és mások.
Alkinek nevezzük telítetlen szénhidrogénekből az összetételében egy hármas kötést.
Az általános képlet a homológ sor alkinek Cn H2N- 2. képviselői alkinek: acetilén (C2 H2), propin-1 (C3 H4), butin-1 (C4 H6), és mások.
Ciklikus szénhidrogének, valamint alifás és lehet telített és telítetlen természetét, kivéve, hogy a ciklikus szénhidrogének vannak osztva aliciklusos és aromás.
Telített és telítetlen karbociklusos szénhidrogének, aliciklusos kombinált közönséges neve, hangsúlyozva előtag Ali hasonlóságot alifás szénhidrogének.
Telített aliciklusos szénhidrogének cikloalkánok nevezett (általános képletű CnH2n képviselői -. A ciklopropán, ciklobután, ciklopentán, stb), telítetlen és egy kettős kötéssel - cikloalkenil, két kettős kötést - cikloalkadienil. Ismert aliciklusos szénhidrogének és egy hármas kötés, általában a makrociklus.
Az aromás vegyületek a legfontosabb anyagokra vonatkozik, amely molekulák tartalmazhatnak egy vagy több benzolgyűrűvel (ábra. 1). Strukturális őse Ezen anyagok benzol szénhidrogén C6 H6. Szénhidrogének A sorozat együttesen elnevezési - az arénába, és ezek általános képletű - Cn H2N- 6.
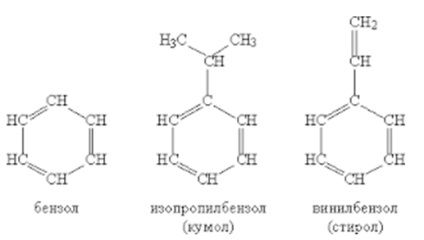
Ábra. 1. Aromás szénhidrogének.
Példák problémák megoldása
Amikor teljes égésű oxigént tartalmazó szerves anyagot tömegű 13,8 g kapott 26,4 g szén-dioxidot és 16,2 g víz. Find molekuláris képlete az anyag, ha a relatív sűrűsége gőzének hidrogén 23.
Felvázolt égési reakciója szerves vegyületek, amelyek megadott számú szénatomot tartalmazó, hidrogén és oxigén az «X», «y» és «Z», rendre:
Tömegének meghatározásához az elemek alkotják az anyag. Az értékek a relatív atomi tömegeket venni a periódusos D. Mengyelejev, egész számra kerekítve: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Kiszámítjuk a moláris tömege a szén-dioxid és víz. Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = [26,4 / 44] × 12 = 7,2 g;
m (H) = 2 × 16,2 / 18 × 1 = 1,8 g
m (O) = m (Cx Hy Oz) - m (C) - m (H) = 13,8 - 7,2 - 1,8 = 4,8 g
Definiáljuk a kémiai képlet szerinti vegyület:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (O) / Ar (O);
x: y: z = 7,2 / 12 1,8 / 1: 4,8 / 16;
x: y: z = 0,6. 1.8. 0,3 = 2: 1 6.
Ezért a legegyszerűbb általános képletű vegyületet a C2 H6 O moláris tömege 46 g / mol [M (C2 H6 O) = 2 × Ar (C) + 6 × Ar (H) + Ar (O) = 2 × 12 + 6 × 1 + 16 = 24 + 6 + 16 = 46 / mol].
Moláris tömeg szerves anyag lehet meghatározni a sűrűsége a hidrogén:
Msubstance = 2 × 23 = 46 g / mol.
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyület kapott móltömeg:
Ez azt jelenti, egy szerves vegyület, a képlet formájában fog a C2 H6 O.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Mi tömegének kiszámításához oxigénfrakciót a mix:
ω (O) = 100% - ω (P) = 100% - 56,4% = 43,6%.
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (foszfor) „y” (oxigén). Ezután a mólarány a következő lesz (az értékek a relatív atomi tömegeket vett Mendeleev periódusos, egész számra kerekítve):
x: y = ω (P) / Ar (P). ω (O) / Ar (O);
x: y = 1,82. 2,725 = 1. 1,5 = 2. 3.
Ezért legegyszerűbb képletű foszfor-oxigén-vegyületek lesz formájában P2 O3 és móltömege 94 g / mol [M (P2 O3) = 2 x Ar (P) + 3 × Ar (O) = 2 × 31 + 3 × 16 = 62 + 32 = 94 g / mol].
Moláris tömeg szerves anyag lehet, amelyet annak sűrűsége légi:
Msubstance = 29 × 7,59 = 220 g / mol.
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyület kapott móltömeg:
Ezért az indexek foszfor és oxigén atomok kell két-szer nagyobb, azaz a anyagok képlet lesz formájában P4 O6.