Formula bázisok kémiában
Grounds - elektrolitok, csak meg OH-ionok képződnek disszociációs ahonnan negatív ionok -.
Fe (OH) 2 ↔ Fe 2+ + 2OH -;
Minden bázisok általában szerves és szervetlen (a szerves bázisok közé aminok - ammónia-származékok, amelyekben a hidrogénatomokat szubsztituált szénhidrogéncsoport, (R-NH 2) általános képletű aminokat (korlátozó) CnH2n + 3 N ..), ami szintén a saját (belső) minősítést.
Normális körülmények között, jelentős mennyiségű szervetlen bázisok létezik a szilárd állapotban, egyes amorf (Cu (OH) 2).
Szerves bázisok metil-amin, dimetil-amin és trimetil-amin - gázok, az átlagos tagja az alifás sor - folyékony, magasabb - szilárd anyagok. Alsó aminok könnyen oldódik vízben, és van egy szúrós szagú.
Kémiai képletek bázisok
Kémiai képletek bázisok gondoljunk néhány képviselője (mind szervetlen, mind szerves): Nátrium-hidroxid NaOH, hidroxid réz (II) - Cu (OH) 2 imetilamine - CH3 NH2. Kémiai képlet mutatja a minőségi és mennyiségi összetétele a molekula (száma és típusa atomok tartalmazza a specifikus vegyület) szerint az alábbi vegyi képlet alapján számítható móltömegű zsírsavak (Ar (H) = 1 amu Ar (Na) = 23a.e.m. Ar (Cu) = 64a.e.m. Ar (O) = 16 amu Ar (N) = 14 amu Ar (C) = 12 amu):
Mr (NaOH) = Ar (Na) + Ar (O) + Ar (H);
Mr (NaOH) = 23 + 16 + 1 = 40.
Úr (Cu (OH) 2) = Ar (Cu) + 2 × Ar (H) + 2 × Ar (O);
Úr (Cu (OH) 2) = 64 + 2 × 1 + 2 × 16 = 64 + 2 + 32 = 98.
Úr (CH3 NH2) = 12 × 5 + 1 + 14 = 12 + 5 + 14 = 34.
Structure (grafikus) általános képletű bázisok
Structure (grafikus) általános képletű anyag jobban intuitív. Ez azt mutatja, hogy az atomok vannak csatlakoztatva egymáshoz a molekula belsejében. Rámutatunk a szerkezeti képlet minden a fenti vegyületek:
Ábra. 1. Szerkezeti képlet nátrium-hidroxid.
Ábra. 2. Szerkezeti képlet hidroxid réz (II).
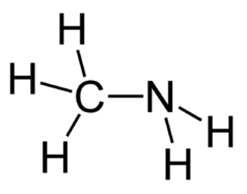
Ábra. 3. A szerkezeti képlet metil-amin.
ionos képletű
Az összes bázist a szervetlen elektrolitok, azaz lehet disszociál ionokra vizes oldatban:
NaOH ↔ Na + + OH -;
Cu (OH) 2 ↔ Cu 2+ + 2 OH -.
Példák problémák megoldása
Korlátozásával neutralizáló 25,5 g egybázisú sav feleslegét különítettek 5,6 l (STP) gázt nátrium-hidrogén-karbonát-oldattal. Határozza meg a molekula képletét a sav.
Az egyenlet semlegesítés korlátozó monosav feleslegben alkalmazott nátrium-karbonát-oldattal, egy általános formája:
Kiszámítjuk a anyagmennyiség a reakció során felszabaduló szén-dioxid:
n (CO2) = 5,6 / 22,4 = 0,25 mól.
Kiszámítjuk a móltömeg korlátozó egybázisú sav:
Definiáljuk a szénatomok száma a molekulában korlátozó egybázisú sav (értékei a relatív atomi tömegeket vett Mendeleev Periódusos Táblázat egész számra kerekítve: 12 - a szén-dioxid, 1-16 hidrogén és oxigén):
M (CnH2n + 1 COOH) = 12N + 2n + 1 + 12 + 16 + 16 + 1 = 14n + 46;
14n + 46 = 102 g / mol;
Ez azt jelenti, molekuláris képlete korlátozó egybázisú sav C4 H9 COOH.