Általános jellemzői az elemek a fő alcsoportja az V. csoportba

Nitrogén alcsoportot áll öt elem: nitrogén, foszfor, arzén, antimon és bizmut. Ez a p-V elemek a periódusos D. I. Mendeleeva.
A külső energia szintje a atomok ezen elemek tartalmaznak öt elektronok amelyek ns2np3 konfiguráció és a következőképpen oszlik meg:
Ezért a magasabb oxidációs foka ezen elemek 5, alacsonyabb -3, és +3 jellemző.
A jelenléte három párosítatlan elektront a külső szinten azt jelzi, hogy a undriven állapotban elemek atomok vegyértékét 3. A külső réteg a nitrogénatomok áll csak két sublevels - 2s és 2p. Atomjai a fennmaradó elemeit az alcsoport a külső energia szintje betöltetlen sejt D-Sub. Következésképpen, az egyik a külső szintek s-elektronok mozoghat, amikor gerjesztett d-alréteg ugyanazon a szinten, amely képződéséhez vezet 5 párosítatlan elektront.
a külső elektron héj foszfor (gerjesztett atom)
külső elektron héj a gerjesztett foszforatom.
Így, foszfor, arzén, antimon és bizmut a gerjesztett állapotban van öt párosítatlan elektront a saját vegyérték és ez az állapot egyenlő 5.
A nitrogénatom gerjesztésére egy elektron ilyen módon nem lehet hiánya miatt d-alréteg a második szinten. Következésképpen, ötértékű nitrogént nem lehet, azonban ez lehet kovalens kötést képez egy negyedik donor-akceptor mechanizmus miatt a magányos elektronpár 2S2. Ahhoz, hogy egy nitrogénatom, és a lehetséges egyéb folyamat. Amikor az egyik a két izolációs 2s-elektron nitrogén belép egyszeres töltésű négy vegyértékű ion N +.
A nitrogénatomok bizmut sugarak növekedését és csökkenti a ionizációs potenciál. Redukáló tulajdonsága semleges atomok amplifikáltuk N Bi, és az oxidációs gyengül (lásd. Táblázat. 21).
A hidrogént, nitrogént, foszfort és az arzén formában RH3 poláros vegyület, amely negatív oxidációs állapotban -3. RH3 molekuláknak piramis alakú. Ezekben a vegyületekben, az összekapcsoló elemek hidrogén sokkal tartósabb, mint a megfelelő oxigén-vegyületek, az elemek a alcsoport, és alcsoportok különösen halogénatommal. Ezért, a hidrogén-vegyület nitrogént alcsoport elemeinek vizes oldatok, nem alkotnak hidrogén-ionok.
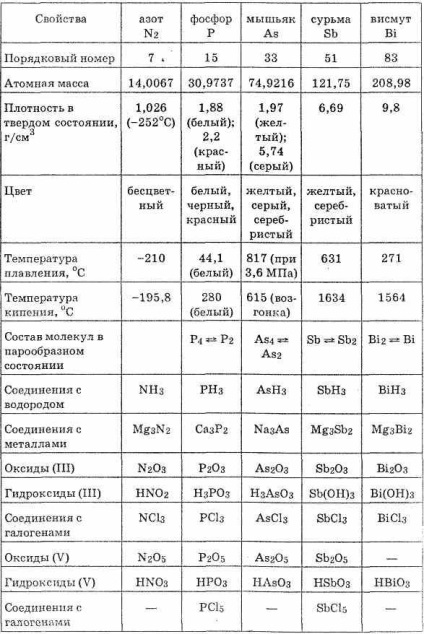
Nitrogén oxigénnel formájában oxidok az alcsoport elemeinek általános képletű R2O3 és R2O5. Oxidok megfelelnek HRO2 sav és HRO3 (és orthoacid H3RO4, kivéve nitrogén). Belül az alcsoport oxidok karakter változik, így: N2O3 - savas-oxid; R4O6 - gyengén savas oxid; As2O3 - amfoter oxid túlnyomórészt sav tulajdonságainak; Sb2O3 - amfoter oxid túlnyomórészt alapvető tulajdonságait; Bi2O3 - alap-oxidot tartalmaz. Így a savas tulajdonságait R2O3 és R2O5 összetétele oxidok csökken növekvő sorszáma az elem.
Amint táblázatból látható. 21, egy adott alcsoport nitrogén bizmut fémes tulajdonságok csökkentik, és növeli a fém. Mi antimon ezek a tulajdonságok azonosak, domináló fém bizmut, a nitrogén - nemfémes tulajdonságokkal. Foszfor, arzén és antimon formában több allotropic vegyületet.
A laboratóriumok lehet bomlása reakciója ammónium-nitrit:
A reakció exoterm, megy, hogy kiadja a 80 kcal (335 kJ), és ezért a hűtés a hajó áramlása során (bár fűtési ammónium-nitrit szükséges a reakció megindításához).
Gyakorlatilag, ez a reakciót úgy végezzük, hogy cseppenként telített vizes nátrium-nitrit fűtött telített ammónium-szulfát-oldattal, eredő reakció pillanatszerűen elbomlik ammónium-nitrit.
A kiszökő gáz szennyezett ammóniával, nitrogén-oxid (I) és az oxigén, amelyből azt megtisztítható át egymást követően megoldások kénsav, vas-szulfát (II) és egy piros-forró fölött réz. Ezután, szárított nitrogénnel.
Egy másik laboratóriumi módszer, nitrogén - keverékét hevítjük kálium-dikromát és ammónium-szulfát (az arány 2: 1 tömegarányban). A reakció egyenleteknek megfelelően:
A legtöbb tiszta nitrogént lehet előállítani bomlás fém azidok:
Az úgynevezett „levegő” vagy „környezeti” nitrogén, vagyis olyan elegyet nitrogén és nemesgáz, állítjuk elő, a levegő a vörös-forró koksz, amely egy úgynevezett „regeneratív” vagy „levegő” gáz - nyersanyagok kémiai szintézisek és az üzemanyag . Ha szükséges, ez izolálható a nitrogén, a szén-monoxid felszívódik.
Molekuláris nitrogén az iparban állítjuk elő frakcionált desztillációval folyékony levegőt. lehet ezzel a módszerrel kapott és a „légköri nitrogén.” Az is széles körben használják a nitrogén növények, amelyek használják a módszert az adszorpciós és a membrán gáz elválasztás.
Egy laboratóriumi módszerek - halad ammónia át a réz-oxid (II) hőmérsékleten
Ammóniát kivettünk a telített oldatban, melegítéssel. CuO mennyiség 2-szer nagyobb, mint a település. Közvetlenül a felhasználás előtt a nitrogén tisztított szennyező oxigénnel és ammóniával áthaladva a rezet és (II) oxidot (szintén
700 ° C), majd szárítjuk tömény kénsavval és az alkáli száraz. A folyamat meglehetősen lassú, de megéri: a gáz kiderül nagyon tiszta.