A teljes reakció során fellépő a cella működése formában van - studopediya
Reakciója biztosítja a vezetőképesség a belső láncban
Reakciók az anód és a katód
A) Zn - 2E = Zn +2. K) Cu +2 + 2e = Cu.
Elektromotoros ereje elektrokémiai cella (elektromotoros erő) a különbség az elektród potenciál a két fél-cella.
Például, hogy Daniel Jacobi elem
Általában, az elektromotoros erő (EMF) a cella által adott
3 hidrogén referencia elektród. elektrokémiai sorozat
Az abszolút értékek elektróda potenciál jelenleg nem ismert, azonban a gyakorlatban a relatív értékeket.
A „hidrogén-elektród” lett kiválasztva, mint a referencia elektród. A berendezés ennek az elektród ábrán látható 9.2.
Ábra 9.2 reakcióvázlat hidrogén elektród hidrogén-elektród - platina lemez meríteni egy 1 M kénsav oldat. Amikor a molekuláris hidrogént vezetünk át az oldaton, hogy adszorbeáljuk platina elektród, ahol a porlasztás történik meg. Ennek eredményeként, a hidrogén a lemezen, és az oldatban egyensúlyi: H + + E «H (z) és a potenciális ugrás # 966; .
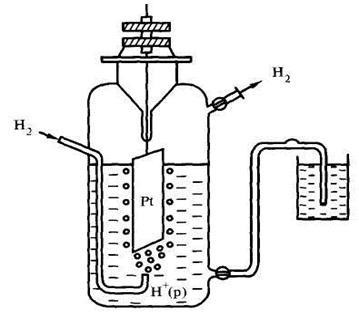
Ahhoz, hogy az eredmények összehasonlíthatók legyenek a mérés alatt végzett a következő standard körülmények: T = 298 K, P = 1 atm. C (só) = 1 mol / l.
Az elektróda potenciálja mérjük voltban (V). A standard hidrogén elektród potenciál hagyományosan venni nulla.
Összhangban csökkenő regeneráló tulajdonságait fémek vannak elrendezve a következő elektrokémiai szekvenciája:
Li K Na Mg Al Ti Mn Zn Fe Pb H Bi Cu Ag Pt Au.
Az elektrokémiai sorban vannak elrendezve, hogy a bal oldalon a hidrogén standardpotenciál fémek, amelyek negatív értéket, és a jobb a hidrogén - fémek amelynek standardpotenciál pozitív értékek.
4 Nernst-egyenlet
Ha a feltételek eltérnek a standard, az értéke az elektród potenciál kiszámítása a Nernst-egyenlet.
ahol R - az univerzális gázállandó (8,31 J / mol · K),