A kémiai kötés energiát
Összefogás atom elektron lép fel, ha van egy energia nyereség, vagy más szavakkal, ha az abszolút értéke a potenciális energia az atom + elektron következtében növekszik, az elektron-atom.
A szempontjából az energia nyereség, kötés kialakítása - egyfajta közötti közbenső csatlakozási folyamat egy elektron a semleges atom (mért elektron affinitás) és az elektron-kötődés az atom, amelynek töltési magok nőtt 1 egység.
Ahhoz, hogy értékelje a kötési energia a molekulák, álló többelektronos atomok szükséges megbecsülni:
- kötés energia a kötő elektronok a magok,
- magtöltés többelektronos atomok,
- az energia az elektron-elektron taszítás kötő elektronok a többi az elektronok a molekulában.
Az arány közötti ionizációs energia és felelős a mag lehet a következőképpen fejezhető ki (lásd a kémiai kötés energiája hidrogénatom.)
ahol EionZ és EionH - az ionizációs energia: hidrogén-szerű atom és atom töltéssel Z.
Abban az esetben, több elektron atomok, atommagok felelős alkalmazott érték a számítás nem érvényes díjakat atommagok ezen atomok. Ezekben a számításokban használhatja az úgynevezett hatékony nukleáris költségek (pozitív töltések, amelyek hatnak a kötődési elektronpár).
Hasonlóképpen egyenlet (4,3-1), az értéke a internukleáris taszítás szükséges energia becslésére az energia a molekula becsléssel is a hatékony nukleáris töltés a következő kifejezéssel:
ahol Erepeff - hatékony internukleáris taszítás energia álló molekula két atom; ErepH2 - taszítás energia a molekula H2; Zeff1 és Zeff2 - hatásos töltetek az első és második atommagba a internukleáris taszítás.
Kiszámítottuk az energia egy kémiai kötés kétatomos molekulák, melyek az atomok és az elektronok száma, mint egy elektron-alkilcsoport vagy hidrogénatom atomból egy nukleáris díjat, egyenlő a tényleges költség, a mag ezen molekulák.
Annak megállapításához, a változás az elektron energia kialakulását a molekulák a atomok azonos típusú, mint abban az esetben a hidrogén molekula, kivonjuk az energiát a két atom távolságra levő molekuláris energia, és látjuk, hogy ez az energia egyenlő a kötés energia a molekulában.
Most visszatér a magyarázata a kötési energia a D csoport táblázat 4.4. >>
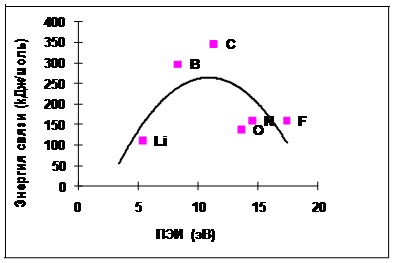
Ábra. 4.3-2 Kísérleti adatok a függőség a kémiai kötés energia a molekulában X-X X atom PEI elemeket a második időszak
Ábra. 4.3-2 és 4.3-3 mutatja a kémiai kötés energiája PEI alkotó atomok a molekula.
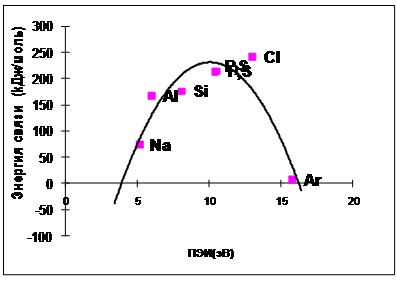
Ris.4.3-3 a molekulában X-X X atom PEI elemeket a harmadik időszak a kémiai kötés energiafüggőségét (számított és kísérleti adatok).
Azt feltételezték, hogy az energia egy kémiai kötés, és PEI (mindkettő által meghatározott elektrosztatikus kölcsönhatás) korrelált. A számított energiafüggőség alakja van egy parabola. Azaz, amikor a PEI növeljük 5-11 eV [a lítium (Li), hogy a szén (C)], növeli az energia egy kémiai kötés, és a további, növekedést PEI a 11 20 eV kötési energia csökken.
Szerint a kísérleti adatok, a kötési energiája az atomok is megnövekszik tartományban 5 és 11 eV, de egy további növekedés a PEI 11 hogy 16 csepp 0.
Egy másik egybeesése kísérleti és a számított függőségek sugallja helyességét magyarázata a természet a kémiai kötés.
A kémiai kötés energiát