A hőmennyiség, a termikus hatása, képződéshő, feladatok 81- 87
A hő mennyisége
Zadanie81.
Számítsuk ki a hőmennyiség, amely során felszabaduló a helyreállítása Fe 2O 3, fém alumínium, ha kapunk 335,1 g vas. A: 2543,1 kJ.
megoldás:
Reakció egyenlet:
Értékeit a standard futamok megalakult a felsorolt anyagok különleges asztalok. Tekintettel arra, hogy a képződéshő egyszerű anyagok hagyományosan vett nulla. Számolja a reakcióhő segítségével következtében Hess, megkapjuk:
= (Al 2O 3) - (Fe 2O 3) = -1669,8 - (- 822,1) = -847,7 kJ
Kiszámítása a hőmennyiség, amely felszabadul előállítása során 335,1 g vas, a pro-meggyötört arányok:
ahol 55,85 atomsúlyának vas.
Hő reakció
Feladat 82.
Gáznemű etanol C2H5OH úgy állíthatjuk elő, hogy etilén-C2 H4 (Z) és a vízgőz. Írja termokémiai egyenletet a reakció előtti kiszámításához termikus hatása. Válasz: -45,76 kJ.
megoldás:
Reakció egyenlet formájában:
C2 H4 (g) + H2O (g) = C2H5 OH (g); =.
Értékeit a standard futamok megalakult a felsorolt anyagok különleges asztalok. Tekintettel arra, hogy a képződéshő egyszerű anyagok hagyományosan vett nulla. Számolja a reakcióhő segítségével következtében Hess, megkapjuk:
= (C 2H 5OH) - [(C2 H4) + (H2 O)] =
= -235,1 - [(52,28) + (-241,83)] = - 45,76 kJ
Reakció egyenlet, amely meghatározza azok Államok aggregáció vagy kristálymódosulat körül karakterek kémiai vegyületek, valamint a számértéke a hőhatás nevezzük termokémiai. A termokémiai egyenletek, hacsak az értékek a megadott termikus hatások állandó nyomáson Qp egyenlő entalpia változás rendszer. Az érték eredménye általában a jobb oldalon az egyenlet, elkülönítve azt vessző vagy pontosvessző c. A következő rövidítéseket jelöli a halmazállapot az anyag: R - gáz halmazállapotú w - folyadék - kristályos. Ezek a szimbólumok elhagyható, ha a fizikai halmazállapot nyilvánvaló például, O2. H2 és mtsai.
Ha a felszabaduló hőt a reakció, akkor <О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
Feladat 83.
Számítsuk ki a reakció-hő csökkentésének vas-oxid (II) hidrogén, az alábbi termokémiai egyenletek:
megoldás:
Egyenlet redukciós reakciót vas-oxid (II) hidrogén-a formája:
EEO (k) + H2 (z) = Fe (k) + H2 O (g); =?
Értékeit a standard futamok megalakult a felsorolt anyagok különleges asztalok. Tekintettel arra, hogy a képződéshő egyszerű anyagok hagyományosan vett nulla. A reakcióhő segítségével számítható a vizsgálatban, azaz a törvény Hess:
A képződéshő víz alábbi egyenlettel határozható meg
és a hő képződésének vas-oxid (II) lehet a következő egyenletből számítjuk (b) vonjuk ki a egyenletet (a).
= (A) - (b) - (a) = -241,83 - [-283, o - (-13,18)] = +27,99 kJ.
Feladat 84.
A reakcióban gáz halmazállapotú hidrogén-szulfid és szén-dioxid képződik vízgőz és szén-diszulfidot CS2 (g). Írja termokémiai egyenletet a reakció előszámítása termikus hatása. Válasz: 65,43 kJ.
megoldás:
Reakció egyenlet, amely meghatározza azok Államok aggregáció vagy kristálymódosulat körül karakterek kémiai vegyületek, valamint a számértéke a hőhatás nevezzük termokémiai. A termokémiai egyenletek, hacsak az értékek a megadott termikus hatások állandó nyomáson Qp egyenlő entalpia változás rendszer. Az érték eredménye általában a jobb oldalon az egyenlet, elkülönítve azt vessző vagy pontosvessző c. A következő rövidítéseket jelöli a halmazállapot az anyag: R - gáz halmazállapotú w - folyadék - kristályos. Ezek a szimbólumok elhagyható, ha a fizikai halmazállapot nyilvánvaló például, O2. H2 és mtsai.
Reakció egyenlet formájában:
2H2 S (g) + CO 2 (g) = 2H2 O (g) + CS2 (Z) =?
Értékeit a standard futamok megalakult a felsorolt anyagok különleges asztalok. Tekintettel arra, hogy a képződéshő egyszerű anyagok hagyományosan vett nulla. A reakcióhő segítségével számítható a vizsgálatban, azaz a törvény Hess:
= (H2 O) + (CS2) - [(H2S) + (CO2)];
= 2 (-241,83) + 115,28 - [2 (-20,15) + (-393,51)] = 65,43 kJ.
Termokémiai egyenlet a következő lesz:
2H2 S (g) + CO 2 (g) = 2H2 O (g) + CS2 (g); = 65,43 kJ.
Termohimicheskoe reakcióegyenlet
Feladat 85.
Írja termokémiai egyenlete közötti reakciót CO (g) és hidrogén, ami a kialakulását CH4 (g) H2 O (g). Hogy a felszabaduló hőt a reakció során, amikor a metán 67,2 liter megszerzésének alapja a normális állapot? Válasz: 618,48 kJ.
megoldás:
Reakció egyenlet, amely meghatározza azok Államok aggregáció vagy kristálymódosulat körül karakterek kémiai vegyületek, valamint a számértéke a hőhatás nevezzük termokémiai. A termokémiai egyenletek, hacsak az értékek a megadott termikus hatások állandó nyomáson Qp egyenlő entalpia változás rendszer. Az érték eredménye általában a jobb oldalon az egyenlet, elkülönítve azt vessző vagy pontosvessző c. A következő rövidítéseket lásd a halmazállapotban az anyag, r - gáz halmazállapotú, jól - valami - kristályos. Ezek a szimbólumok elhagyható, ha a fizikai halmazállapot nyilvánvaló például, O2. H2 és mtsai.
Reakció egyenlet formájában:
CO (g) + 3H2 (g) = CH4 (g) + H2 O (g); =?
Értékeit a standard futamok megalakult a felsorolt anyagok különleges asztalok. Tekintettel arra, hogy a képződéshő egyszerű anyagok hagyományosan vett nulla. A reakcióhő segítségével számítható a vizsgálatban, azaz a törvény Hess:
= (H2 O) + (CH4) - (CO)];
= (-241,83) + (-74,84) - (-110,52) = -206,16 kJ.
Termokémiai egyenlet a következő lesz:
22,4: 67,2 = -206,16: x; x = 67,2 (-206,16) / 22 4 = -618,48 kJ ?; Q = 618,48 kJ.
képződéshő
Feladat 86.
A termikus hatása a reakció egy képződéshő. Számoljuk ki a képződéshő NO alapján a következő termokémiai egyenletek:
a) 4NH3 (g) + 5O2 (g) = 4NO (g) + 6N2 O (g); = -1168,80 kJ;
b) 4NH3 (g) + 3O2 (g) = 2n2 (g) + 6N2 O (g); = -1530,28 kJ
Válasz: 90,37 kJ.
megoldás:
Szabványos képződéshő egyenlő a reakcióhőt, képződése 1 mol az anyag egyszerű anyagok standard körülmények között (T = 298 K, P = 1,0325 105 Pa.). NO-képződés az egyszerű anyagok is az alábbi képlettel ábrázolható:
Tekintettel arra, (a) reakció, ahol a kialakult 4 mól NO van megadva, és a reakció (b), amely 2 mól N2. Mindkét részt vevő reakciókat oxigén. Következésképpen, annak meghatározására standard képződéshő NO formában a következő ciklus Hess, azaz, meg kell, hogy tartsák tiszteletben, egyenlet (a) (b) ..:
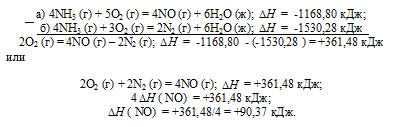
Így, 1 / 2n2 + 1 / 2O2 = NO; = 90,37 kJ.
Feladat 87.
Kristályos ammónium-klorid képződik elő, hogy ammóniát és hidrogén-klorid gázzal. Írja termokémiai egyenletet a reakció előtti kiszámításához termikus hatása. Mennyi hőt van jelölve, ha 10 liter ammónia elfogyott a reakció alapján a normál állapota? Válasz: 78,97 kJ.
megoldás:
Reakció egyenlet, amely meghatározza azok Államok aggregáció vagy kristálymódosulat körül karakterek kémiai vegyületek, valamint a számértéke a hőhatás nevezzük termokémiai. A termokémiai egyenletek, hacsak az értékek a megadott termikus hatások állandó nyomáson Qp egyenlő entalpia változás rendszer. Az érték eredménye általában a jobb oldalon az egyenlet, elkülönítve azt vessző vagy pontosvessző c. Elfogadta az alábbi dolgokat - kristályos. Ezek a szimbólumok elhagyható, ha a fizikai halmazállapot nyilvánvaló például, O2. H2 és mtsai.
Reakció egyenlet formájában:
NH3 (g) + HCI (g) = NH4CI (k). ; =.
Értékeit a standard futamok megalakult a felsorolt anyagok különleges asztalok. Tekintettel arra, hogy a képződéshő egyszerű anyagok hagyományosan vett nulla. A reakcióhő segítségével számítható a vizsgálatban, azaz a törvény Hess:
= (NH4CI) - [(NH3) + (HCI)];
= -315,39 - [-46,19 + (-92,31) = -176,85 kJ.
Termokémiai egyenlet a következő lesz:
A felszabaduló hő a reakció során, 10 liter ammóniát a reakció meghatároztuk a pro-részek:
- Ön itt van:
- legfontosabb
- feladatok
- Kémia-Shimanovich
- Elektronikus egyenlete anódos és katódos folyamatok | Feladatok 287-289