Vanádium-oxid (v)
Az oxid vanádium (V), vanádium (V) -oxid - szervetlen vegyület száma oxid kompozíció V 2O 5 normál körülmények között - sárgásbarna por, vízben oldható. Az anyag mérgező. Amfoter jellemzőket mutat, amelyek túlnyomórészt savasak.
A vanádium-oxid a legfontosabb vanádium-vegyület. Katalizátorok, speciális üvegek, pigmentek gyártásához használják.
Terjesztés a természetben
Mivel a vanádium-oxid könnyen képez hidrát ásványi lerakódások éppen vízzel kombinálva - mert ismert hidrátok Alait V 2O 5-H 2O, és V 2 navahoit O 5 · 3H 2 O.
Szintén ez része a természetes vanadátokat: vanadinit 3PB 3 (VO 4) 2 · PbCl 2, carnotit K 2 (UO 2) 2 [VO 4] 2 · 3H 2 O, dekluazitu (Zn, Cu) Pb (VO 4) (OH ), FeVO 4 * 2H 2 O ferrule, BiVO puerite 4 tonna.
Fizikai tulajdonságok
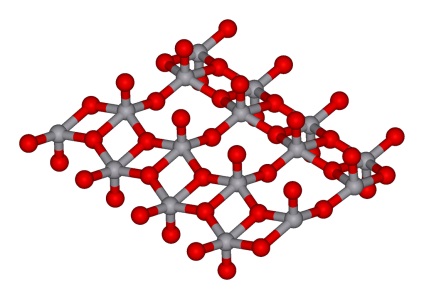
A vanádium-oxid mérgező por, szagtalan és íztelen. A színe narancssárga és téglabarna közötti. Amikor folyékony állapotból lehűtik, gyenge paramágneses tulajdonságokkal redukált rhombikus tűkre kristályosodik.
Vanádium-oxid foglal egy közbenső helyzetben képest magasabb-oxidok a 4. és 6. csoportban annak időszak - TiO 2 és CrO 3 Különösen, ez kevésbé stabil, mint a titán-oxid és a króm-oxid-rezisztens.
A vanádium-oxid szintézisének fő módszere az ammónium-vanadátok termikus bomlása a levegőben:
Szintén a vanádium por égetése nyomás alatt lévő oxigén áramban történik:
Kevésbé gyakori módszerek a vanadilvegyületek termikus bomlása és hidrolízise:
Kémiai tulajdonságok
A vanádium-oxid (V) egy viszonylag instabil oxid, amely melegítéskor megolvad és bomlik, így vanádium (IV) -oxid keletkezik:
(szennyezések V 6 O 13)
Ez gyakorlatilag nem reagálnak a vízzel, az oldatból kicsapjuk a hidrát V 2O 5 · nH 2O (n = 1, 2, 3).
Az interakciók során az oxid amfoter tulajdonságokkal rendelkezik, jelentős savas tulajdonságokkal rendelkezik. V 2O 5 savasabb oxid és erősebb oxidálószer, mint a szomszédos titán-oxid (IV), de gyengébb, mint a króm-oxid (VI).
Továbbá kationok vanadil erősen savas oldatokban és ortovanadát anion erősen, részecskék (VO 3) is képezhetők a közepesen savas oldatot -, (HVO 4) 2, (V 3 O9) 3, (V 4 O12) 5 -, (V 10O 28) 6- és mások.
Fűtés közben az oxid hidrogénnel, klórral, tellúral, kén (IV) -oxiddal reagál:
Ez utóbbi reakció fontos lépés a kénsav katalitikus termelésében.
Az oxidból származó vanádiumot csak a kalcium hatása csökkenti, míg alumínium esetén V-Al ötvözet képződik.
Fontos vanádium ötvözet ötvözet a ferrovanadium, amelyet a V 2 O 5 és a Fe 2 O 3 általános csökkentésével állítanak elő:
toxicitás
A vanádium-oxid (V) veszélyes. Belégzése komolyan irritálja a légutakat, légzési nehézség és asztma társulhat, ami negatív hatással van a tüdőre. Az anyag lenyelése potenciálisan halálos, mivel bejutott a szervezetbe, hatással van a központi idegrendszerre. A bőrrel való érintkezés allergiás reakciót okozhat. A vanádium-oxid potenciálisan rákkeltő anyagnak minősül.
kérelem
Vanádium-oxid széles körben használják katalizátorként homogén katalízis és heterogén - a termelés kénsav, a ftálsav és maleinsav-anhidrid, adipinsav és akrilsav. Szintén kis mennyiségeket használnak oxálsav és antrakinon előállítására.
Ez egy komponense speciális üveg, késlelteti ultraibolya sugárzás, ez is gyártásához használt pigmentek (sárga SnO 2 / V 2O 5 és ZrO 2 kék / V 2 O5), és mind antisztatikus réteget fényképészeti anyagok.