A vanádium-oxidok kémiai katalógusa
VANADIUM-OXIDOK
VANADIUM-OXIDOK. A legfontosabb VANADIUM OXIDEK jellemzői a. a táblázatban szerepelnek. A V oxidációs állapot növekedésével az oxidok savas tulajdonságai fokozódnak, valamint kémiai stabilitásuk. Sokak számára Vanadia Oksida szól. a homogenitás meglehetősen széles tartománya jellemző (lásd a táblázatot és az ábrát).
VO monoxid vízben oldhatatlan; híg szervetlen savakkal a V (II) sók halványkék vagy ibolyaszínű oldatait képezik. Erős redukálószer. A V2O5 hidrogénnel történő csökkentésével 1700 ° C hőmérsékleten nyerhető. Hidroxid V (OH) 2. amely a lúgok hatására képződik a V (II) sók oldatában, egy egyedi formában nem áll rendelkezésre.
A Sesquioxide V2 O3 két kristályos. módosításokat; -105 ° C-on a képződés átalakul (átmenet 1,8 kJ / mol), amely egy antiferromágnes, a Néel hőmérséklete 168 K. vízben, nem oldószerben; szervetlen savakkal S (III) sókat képez. Erős redukálószer. Ezt a V2O5 szén-monoxiddal, H2-vel történő csökkentésével nyerik. S, stb. Alkalmazva vanádium bronzok gyártására, termisztorok anyagaként. Karelianit ásvány formájában jelenik meg a természetben. A hidroxid V (OH) 3 alkáli vagy ammónium-hidroxid hatására képződik a V (III) sók oldatainak levegőhöz való hozzáférése nélkül.
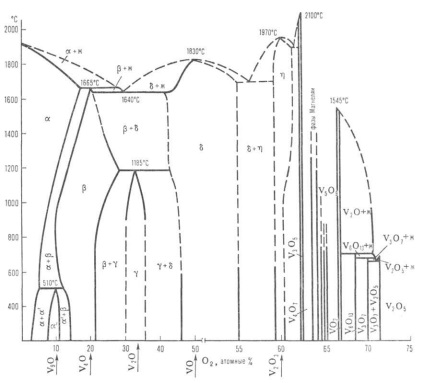
A vanádium-oxigén rendszer állapotának diagramja: M-olvadék; szilárd oldat (-O2 V; -alapú V9 O; -alapú V4 O; -alapú V2 O; -alapú VO; -alapú V2 Oz); A szaggatott vonalak jelzik a fázisok közelítő határait.
A trinádium-pentoxid V3O5 antiferromagnet, a Neel hőmérséklete 270 K; a 430 K-on fémes lesz. vezetőképesség.
A VO2-dioxid két kristályos anyagban létezik. módosításokat; 68 ° Sforma alakítjuk (átmeneti 3.1 kJ / mol) A forma - antiferromagnet, a Neel hőmérséklete 345 K. Nem oldható vízben. Nedvszívó. Amfoteren: savas oldatokban képző kation vanadil VO 2+ (oldat színe halvány kék), alkalikus ad vanadátokat (IV) - sót nem izoláljuk a szabad állapotú izopolivanadievoy (IV) sav H2 V4 O9. Helyreállítási anyag. Levegővel oxidálva. A V2O5 ötvözetét oxálsavval ötvözve levegő nélkül, V2O3 és V2O5 keverékével melegítjük. a V2O3 oxidációjával. A vanádium bronzok gyártásánál, a termisztorok félvezető anyagaként, a memória elemek, a kijelzők stb. Kapcsolóinak.
Hidroxid VO (OH) 2 - rózsaszínű kristályok; csapadék válik ki 4 pH-értékű oldatokból. Amfoterén.
A 700 ° C feletti Pentaoxid divanadium V2O5 disszociálódik. A diamágneses. N típusú félvezető; zenekari rés
2,5 eV. A vízben való oldhatóság 0,35 g / l 25 ° C-on; vizes oldatokban a valószínű összetételű H2 [O (V2O5) 2,5] izopór-nátrium (V) sav formájában van jelen. Savas oldatokban a V (V) lehetséges lehetséges formái VO2 + és VO3 + ionok. Amikor ezeket az oldatokat melegítjük (pH 1-2), a V2O5 * xH2O változó összetételű hidrátokat izoláljuk, a vanadátumokat (V) lúgos oldatokban formáljuk. A technikai V2 O5 előállításához lásd: Vanádium. A Pure V2O5-t úgy állítják elő, hogy az NH4 VO3-at 400-500 ° C-on lebontják, ezt követően az O2-áramnak való kitettséggel. a VOCl3 hidrolízise. A pentaoxid közbenső termék a ferrovanadium, vanádium, vanadátok stb. Előállításában. V vegyület; katalizátor H2S04 előállításához; komponens specifikáció. szemüvegek, mázok és a piros fény lumineszcenciája. Természetben ásványi schungait formájában fordul elő.
A VANADIUM-OXIDOK TULAJDONSÁGAI
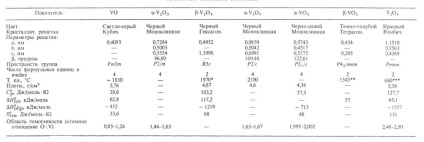
* Forráspont - 3000 ° C (különböző). ** Forráspont
Öt VANADIUM-OXIDES ismeretes. homológak. a Vn O2n-1 sorozat (a Magnelli fázis), ahol u = 4-8. Triclinikus rácsból álló fekete kristályok. Fémből van szó. vezetőképesség alacsony hőmérsékleten (a V7O13 kivételével). Antiferromágneses. M. b. a termisztorok félvezető anyagaként használják. A vanádium szintén oxidokat tartalmaz V3 O7 és V6 O13 - fekete kristályokat egy monoklinikus rácskal, amely nem megfelelő módon olvad össze: az első - 660-680 ° C-on a V6O13 képződéséhez. a második - 700-710 ° C-on VO2 képződéssel. VANADIUM OXIDES kb. mérgezőek. V2 O5 MPC 0,1 mg / m3 (füst), 0,5 mg / m3 (por).
Kémiai enciklopédia. 1. kötet >> A cikkek listájához