Vér-koaguláció
OBSTETRICS ÉS GYNECOLÓGIAI TANSZÉK
A vérzés traumás károsodása utáni vérzés megszüntetése hemostasisnak nevezik.
A hemostazis négy fázisa van:
· Az első fázis a sérült hajó csökkentése. Ugyanakkor csökken a distalis régió vérellátása a sérülésektől.
· A második fázis egy laza vérlemezke-dugó vagy fehér rögképződés kialakulása a sérülés helyén. A sérülés helyén jelen lévő kollagén a vérlemezkék kötőközpontjaként szolgál; az utóbbiban, a kötés eredményeként, belső szerkezetük megsemmisül, és a tromboxán és az ADP felszabadul. Ezek pedig új trombociták kötődését indukálják, és így laza ideiglenes dugó keletkezik. A hemostasis ezen fázisának időtartamát a vérzés tartama határozza meg.
· A harmadik fázis - vörös vérrög kialakulása (vérrög).
· Negyedik fázis - a vérrög részleges vagy teljes feloldódása.
Háromféle trombita vagy vérrögképződés létezik:
A fehér thrombus (az első típus) vérlemezkékből és fibrinből képződik; viszonylag kevés vörösvérsejt van benne. Sérüléses helyeken vagy patológiásan megváltozott edényfalon alakul ki magas véráramlási sebesség mellett (az artériákban).
A második típusú thrombus diffúz fibrin lerakódások nagyon kis hajókban (kapillárisok).
· A thrombus harmadik típusa - vörös vérrög - vörösvérsejtekből és fibrinből áll. A vörös vérrög morfológiája hasonló a kémcsőben kialakult vérrögök morfológiájához. Piros vérrögök alakulnak ki in vivo a késleltetett véráramlás területén, az érfal falán, a sérülés helyén vagy az induló trombocita dugó után a hajó megváltozott falán bekövetkező patológiás változások hiányában.
- A trombusképződés megindulását szövetkárosodásra válaszul külső véralvadási útvonalon végezzük.
- Kezdeményezése trombusképződés vörösvérsejtek késleltetett vagy rendellenes érfal hiányában szöveti károsodás belső úton a koaguláció.
- A koaguláció külső és belső módjai közös végső úton érnek véget. Ebben a szakaszban a protrombin átalakul trombinra és a trombinnal katalizált fibrinogén átalakulásra fibrin trombus formájában.
1. táblázat: Az alvadási tényezők számozási rendszere.
A számok nem tükrözik a tényezők sorrendjét
A fibrinogén trombin által katalizált fibrinné való átalakulása
Fibrinogén (faktor I. lásd az 1. ábrát és 1. táblázat, ...) - egy oldható plazma glikoprotein a májban szintetizálódik, a molekula hossza 46 nm, moláris tömege 340000 molekula áll hat polipeptid-láncok (két A # 945; - láncok, két B # 946; -csíkok és kettő # 947; -lánc). A fibrinogén szerkezete - A # 945; 2 B # 946; # 947; B # 946; - és # 947; - a láncok komplex oligoszacharidokat tartalmaznak Asn-maradékokhoz kapcsolva. A fibrinogén molekulák vége erős negatív töltéssel rendelkezik; ez annak a következménye, hogy nagy számú aszpartát és glutamát maradék jelenik meg az A lánc A régiójában # 945; és a B # 946 lánc régiójának B-régiójában; (1. ábra). Ezenkívül a B-lánc B-régiója # 946; sztornógiailag negatív töltésű tirozin-O-szulfát maradékot tartalmaz. A negatív töltésű végei fibrinogén molekulák nem csak elősegítik a legújabb oldhatósága vízben, hogy nyomja a végei más molekulák a fibrinogén, amely megakadályozza az aggregáció az utóbbi.
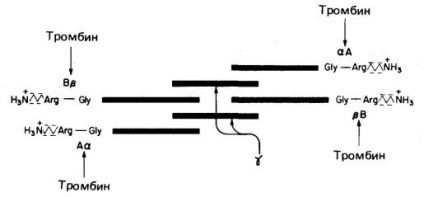
Ábra. 1. A fibrinogén vázlatos ábrázolása, szerkezete (A # 945, B # 946, # 947;) 2. töltött végek, négy Arg-Gly peptidkötés trombin hasítási helyei (nyilai).
A thrombin szerin proteáz egy mólal. m 3400, amely két polipeptidláncból áll. A thrombin négy Arg-Gly peptidkötést fibrinogénben hidrolizál (1. ábra). Ebből a négy kötésből két csatlakozó régiót A és # 945; és a másik kettő a B és B régiók # 946; az A # 945 áramkörökben; és B # 946; volt. A fibrinogén molekulából eltávolított A és B fragmensek negatív töltésű fibrinopeptidek. Ennek eredményeképpen egy fibrin monomer, amelynek szerkezete ( # 945; # 946; # 947; ) 2. A hosszú, oldhatatlan fibrin monomerek spontán kapcsolódnak a rendszeres cikcakk szerkezetekbe; Ennek eredményeképpen oldhatatlan polimer fibrin-rögök képződnek. Ez rögzíti a vörösvérsejtek, vérlemezkék és más vérkomponensek, így a vörös trombust vagy fehér trombus (vérlemezke dugót). Egy korai szakaszában a fibrin vérrög elég konszolidált képződését, tartsa egyetlen rendszer nekovalentnosvyazannoy oldhatatlan fibrin monomerek.
A fibrinogén fibrinbe történő átalakításán kívül a trombin funkciója a XIII faktor aktív formájává (XIIIa) való átalakulása. A XIIIa faktor (transzglutamináz) "keresztkötéses" fibrin monomereket hoz létre specifikus izopeptidkötés kialakítása # 947; a glutamin karboxamid csoportja és # 949; a lizin aminocsoportja (2. ábra). A fibrin rögök stabilizálódása elősegíti visszahúzását. amely in vitro megfigyelhető. Megnövekedett vérzést figyeltek meg örökletes XIII faktor hiányban szenvedő betegeknél. azzal magyarázható, hogy nem képes stabil fibrin rögeget kialakítani.
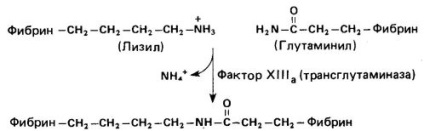
Ábra. 2. A fibrinmolekulák keresztkötése az aktivált XIII faktor hatása alatt.
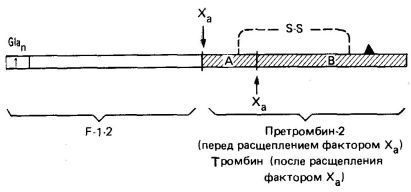
Ábra. 3. A protrombin skematikus szerkezete, az N-vég - bal; Az I. régió tartalmazza a Gla összes maradékát. A hasítási helyeket az Xa faktor és a hasítási termékek neve mutatja. A katalitikusan aktív szerin maradék lokalizációját ▲ jelzi. Az aktív trombin (árnyékolt) A és B láncát a diszulfidhíd együtt tartja.
A protrombin aktiválása a vérlemezkéken történik; anionos thrombocyta-foszfolipid szerepet játszik ebben a folyamatban. Ca 2+ ionok. Va és Xa faktorok.
Foszfolipidek, amelyek a belső oldalon a plazma membrán a vérlemezkék, kiállított eredményeként a kollagén által indukált vérlemezke-degranulációt és megsemmisítése. Ezek a foszfolipidek Ca 2+ ionokat és protrombint kötnek (ez utóbbi a Gla maradékokat tartalmazó N-terminális régió mentén). A vérlemezkék tartalmaznak olyan V faktort is, amely aktivált formában (Va) kötődik a thrombocyta membrán specifikus receptoraihoz (4. ábra). Az Va faktor az Xa faktor receptoraként szolgál, ami viszont az F -1-2 régióban található protrombinhoz kapcsolódik (3. ábra). Az X faktor egy szerin-proteáz, a katalitikusan inaktív prothrombin molekulát a 2. ábrán jelzett területeken hasítja le. 3. Ebben az esetben a protrombin N-terminális része felszabadul. A trombin X-es faktorának hasítása eredményeképpen az A és B trombin polipeptidek képződnek, diszulfidhíd által kötve.
A foszfolipid Ca 2+ ionokon keresztüli kötődése a Gla protrombin aminosavaihoz 50-100 alkalommal fokozza az utóbbi aktiválódását. Ez nyilvánvalóan a prothrombin és az Xa faktor magas lokális koncentrációjának kialakulásából adódik (4. ábra). A Va faktor megnöveli a prothrombin aktiválódását körülbelül 350-szer, ami szintén az Xa faktor lokális koncentrációjának növekedésével magyarázható.
A Va tényező. amelyet az V. faktor trombin hatására képzünk, majd ugyanazt a trombint és inaktiváljuk, ily módon a protrombin trombin aktiválási folyamata korlátozott.
A protrombin a konformációs változások eredményeképpen aktiválható staphylocoagulázzal.
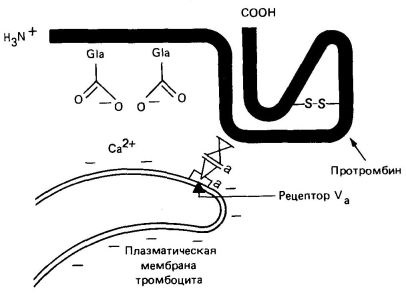
Ábra. 4. A kötési faktorok rendszere Va. Xa. a Ca 2+ ionjait és a thrombocyta plazma membránjával rendelkező protrombint.
X tényező aktiválása
A Xa faktor kialakulásának külső módja
Az Arg-Ile kapcsolat megszakadása. és így az X faktor Xa-faktorra való átalakulását, a VIIa faktort és a szöveti faktort a külső útvonalon végezzük. A VII. Faktor csak a külső pályán mûködik, amely gyorsan bekövetkezik szövetkárosodás után. A VIIa faktor prekurzor - VII faktor (egy másik Gla-tartalmú glikoprotein) szintetizálódik a májban, és trombinnal vagy Xa faktorral aktiválható. A VII. Faktor zimogén, viszonylag nagy endogén aktivitással rendelkezik. A VII-es vagy VIIa-es faktorok X-es faktor hatását felgyorsító szöveti faktor a placentán, a tüdőben és az agyban nagyobb számban fordul elő.
1 ml plazmában körülbelül 3 mg fibrinogént és csak 0,01 mg X-es faktort tartalmaz. Ez azt jelenti, hogy az amplifikációt az alvadási rendszerben kell végezni. Valójában a X faktor Xa-ra történő átalakítása autokatalitikus folyamat, amely erősítésnek tekinthető. A vizsgált reakciócsoportok között nem könnyű megérteni, hogy mi az elsődleges - "csirke vagy tojás"; ebben az esetben IIa faktor (trombin) vagy Xa faktor (5. ábra).
A X a tényező kialakulásának belső módja
Az Xa faktor kialakulásának belső útja a prekallikrein in vivo kölcsönhatásával kezdődik. nagy molekulatömegű kininogén. XII és XI faktorok az aktiváló felületen, valószínűleg kollagénen (6. ábra). A belső útvonal aktiváló felülete az in vitro kísérletekben üveg és kaolin. A XII faktor kölcsönhatása az aktiváló felülettel jobban hozzáférhetővé teszi a kallikrein elleni proteolitikus támadást. A kallikrein hatásának eredményeképpen létrejön egy XIIa faktor, amely előidézi a precalcrerein kallikreinbe való átmenetét. Így van kölcsönös aktiváció. A XII faktor a nagy molekulatömegű kininogénből bradykinint bocsát ki, és aktiválja a XI faktort XIa-ban. Az XI faktor és két egymást követő reakció eredményeként a IX faktor (Gla-tartalmú zimogén) aktiválódik. Az Xa faktor Ca 2+ ionok és savas foszfolipidek jelenlétében lassan aktiválja az X faktort; az aktiválódás ugyanazon Arg-Il e kapcsolódás hasításával történik, amely a VIIa faktort a külső útra osztja. Az X-es faktor aktiválódásának mértéke az Xa faktorral 500-szorosa a VIII-as faktor (vagy VIIIa) jelenlétében. A VIII-as faktor aktiválása. nyilvánvalóan kis mennyiségű trombinra van szükség. A VIII. Faktor nem proteáz; valószínűleg a IX-es faktor receptoraként szolgál, és amikor ez utóbbi lebontja az Arg-Il e kötéseket az X-es faktorban. A véralvadás belső módja lassú folyamat, mivel számos tényező vesz részt benne. Együtt alkotnak egy kaszkád mechanizmust, amely Xa faktort termel (6. ábra).
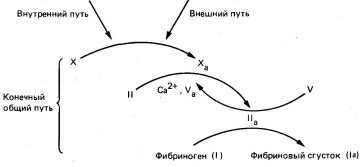
Ábra. 5. A belső, külső és végső közös út közötti kölcsönhatás a véralvadás folyamatában.
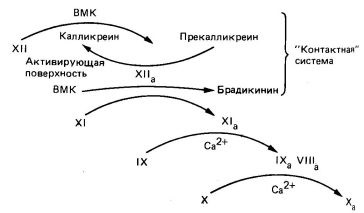
Ábra. 6. Az X tényező aktiválásának belső módja X a-ban. VMK - nagy molekulatömegű kininogén.
Számos örökletes emberi betegség van a véralvadási rendszer különböző összetevőinek elégtelensége miatt. A leggyakrabban megfigyelt VIII-as faktorhiány. meghatározza az A hemofíliát (a megfelelő gén a 10. humán kromoszómán helyezkedik el). Ez a betegség jelentős szerepet játszott a királyi dinasztiák történetében Európában.
A normál plazmát számosféle antitrombin aktivitás jellemzi. Egy kis hozzájárulást tesz hozzá # 945; 1-Antitripszin. A specifikus arányról A 2-globulin az összes antitrombin plazmaaktivitás mintegy 25% -át teszi ki. Trombinra és más proteázokra visszafordíthatatlan komplexet képez, ezáltal megakadályozza az enzimek természetes szubsztrátjaihoz való kötődését. # 945, a 2-Globulin a # 945; 2-inhibitora a plazminnak, mivel inaktiválja a plazminot is, amely fibrinolitikus aktivitással rendelkező szerin-proteáz.
A legnagyobb antitrombinaktivitás a III. Az antitrombin III-nak kevés endogén aktivitása van, és heparin jelenlétében erős aktiválódik, amely nagy negatív töltéssel rendelkezik. Úgy tűnik, hogy a heparin kötődik az antitrombin III specifikus kationos helyéhez. ami konformációs változást okoz a molekulájában. E változás eredményeként az antitrombin III megszerzi az összes szerinproteázhoz kötődés képességét, beleértve a tripszint, a kimotripszint és a plazmint. A véralvadási rendszerben az antitrombin III gátolja a trombin, az Iha, Xa, XIa és XIIa faktorok aktivitását. Az örökletes antitrombin-hiányban szenvedő egyéneknél megfigyelhető a vérrögképződés tendenciája. Ezért arra a következtetésre juthatunk, hogy az antitrombin élettani funkciókat lát el, és hogy általában az ember véralvadási folyamata nagyon dinamikus rendszer.
A heparint gyakran alkalmazzák a klinikai gyakorlatban, mint a véralvadásgátló gyógyszer. A heparin antikoaguláns aktivitását meghatározó fő tényező az antitrombin III aktiválása. ami viszont gátolja a fent vizsgált szerin-proteázokat. Ismert, hogy kis mennyiségű heparin található az edények falán, ennek eredményeképpen a belső útvonal aktiválása csökken. A heparin antikoaguláns aktivitását erősen gátolja a kationos polipeptidek (pl. Protamin). Az ilyen polipeptidek versengenek a III antitrombin kationos helyeihez a polianionos heparinhoz való kötődés szempontjából.
A kumarin-csoport készítményei gátolják a Glu-maradékok K-vitamin-karboxilezését. ami Gla kialakulását eredményezi a II. faktor molekula N-terminális részén. VII. IX és X. Mindezek a faktorok szintetizálódnak a májban, és Gla-maradékok kialakulása szükséges érésükhöz, és ezért a belső, külső és általános terminális véralvadási módok normális működéséhez. Nyilvánvaló, hogy a kumarin készítmények gátolják a K-vitamin kinonszármazékainak redukcióját aktív hidrokinon formákká. A K-vitamin bevezetése eltávolítja a kumarin által okozott blokkot, és biztosítja a Gla-függő alvadási faktorok májképződését. A kumarin K-vitaminnal való kezelését csak 12-24 óra után figyeljük meg; A heparin és a protamin elleni kontraovertatív aktivitásának kezelése szinte azonnal megtörténik; ez a különbség az antagonista mechanizmusok jellegéből adódik.
Meggyőző bizonyíték van arra, hogy a véralvadási rendszer általában dinamikus egyensúlyban van, amelyben a fibrin rögök folyamatosan kialakulnak, majd feloldódnak. A plazmin egy szerin-proteáz, amely fibrinogént és fibrint képes hidrolizálni, V és VIII faktorokat. komplement faktorok és különböző polipeptid hormonok. Normális esetben a plazmát inaktív proenzim (plasminogén) formájában tartalmazzák a plazmában. A test legtöbb szövetében különböző típusú plazminogén aktivátorok vannak. A plazminogén szöveti aktivátora egy szerin-proteáz, amely a fibrinnel való érintkezés hiányában katalitikusan inaktív. Ha a fibrinnel érintkezik, a plazminogén aktivátor képes a plazminogén molekulát lebontani a plazmin kialakítására. Amikor a plazmin hidrolizálja a fibrint, a plazminogén aktivátor elveszti aktivitását, és a proteolízis bomlik. Így a fibrinolízis hatékony szabályozása biztosított. Nagyon ígéretes, hogy terápiás célokra a géntechnológiával nyert szöveti plazminogén aktivátort (TAP) alkalmazzák. A TAP elősegíti a koszorúerek átjárhatóságának helyreállítását, ezáltal csökkentve az akut koszorúér-trombózissal járó szívizom károkat. A plazminogén egy másik aktivátora - a proteolitikus enzim urokináz - a vizeletben található. Az urokináz egy szerin-proteináz; akkor aktiválhatja a plazminogént úgy, hogy két helyre osztja.
A plazminogén rendszerint kicsapódik a fibrinnel, és ezért része a fibrin rögnek. A kapott plazmin a fibrinmolekulákat leoldja oldható fragmensekké, és a vérrög eltűnik (feloldódik). A keresztkötésekkel ellátott fibrin-rácsok nehezebbek plazminnal feloldani.
A plazminogén aktivátorok koncentrációja számos betegségben, például a rák és a sokk egyes formáiban nő. A plazmaellenes aktivitás, a következők miatt: # 945; 1-antitripszin és # 945, a plazmin 2-inhibitora csökkenhet a májzsugorodással. Bizonyos bakteriális termékek, például a sztreptokináz képesek aktiválni a plazminogént a molekula feldarabolása nélkül, és felelősek lehetnek a diffúz vérzésektől, amelyek néha megfigyelhetők a diffúz bakteriális fertőzésekben szenvedőknél.