A glükóz molekulatömege (c6h12o6), képlet és példák
A glükóz molekulatömege
Glükóz (szőlőcukor) - olyan anyag, szerves természetű, az első képviselője egy osztály a szénhidrátok, monoszacharid.
Normál körülmények között színtelen kristályok, édes ízűek és nem szagtalanok. A glükózmolekula szerkezetét az 1. ábrán mutatjuk be. 1. Gyakoriságban (két változatban - α és β) és lineáris formában létezhet. Vízben jól oldódik.
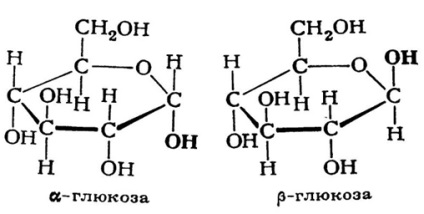
Ábra. 1. A glükózmolekula szerkezete.
A glükóz bruttó formula a C6H12O6. Mint ismeretes, egy molekula molekulatömege megegyezik a molekulát alkotó atomok relatív atomtömegének összegével (a DI Mendeleev periódusos táblázatából vett relatív atomtömegek értéke egész számra kerekítve).
Mr (C6H12O6) = 6 × 12 + 12 × 1 + 6 × 16 = 72 + 12 + 96 = 180.
A moláris tömeg (M) 1 mól tömegű anyag. Könnyen megmutatható, hogy az M moláris tömeg és az M. relatív molekulatömeg számértékek egyenlőek, de az első mennyiségnek az [M] = r / mol dimenziója van, a második dimenzió nélkül:
Ez azt jelenti, hogy a glükóz móltömege 180 g / mol.
Példák a problémamegoldásra
A magnézium, a kén és az oxigén kombinációjának képletét, ha az elemek tömegfrakciói: ω (Mg) = 20%, ω (S) = 26,7%, ω (O) = 53,3%.
Az X elem tömegtörzsét a HX kompozíció molekulájában a következő képlet segítségével számítjuk ki:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük az x (magnézium), y (kén), z (oxigén) vegyületet alkotó mol elemek számát. Ezután a mólarány a következőképpen néz ki (a DI Mendeleyev Periodikus Táblázatából vett relatív atomtömeg értékeit egész számra kerekítve):
x: y: z = ω (Mg) / Ar (Mg). ω (S) / Ar (S). ω (O) / Ar (O);
x: y: z = 20/24. 26,7 / 32: 53,3 / 16;
x: y: z = 0,83. 0,83: 3,33 = 1,14.
Ezért a magnézium-, kén- és oxigénvegyület képlete MgS04 formájában van. Ez magnézium-szulfát.
A nátrium, foszfor és oxigén kombinációjának képletét állítjuk be, ha az elemek tömegfrakciói: ω (Na) = 34,6%, ω (P) = 23,3%, ω (O) = 42,1%.
Az X elem tömegtörzsét a HX kompozíció molekulájában a következő képlet segítségével számítjuk ki:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük meg a "x" (nátrium), "y" (foszfor), "z" (oxigén) vegyületet alkotó mol-elemek számát. Ezután a mólarány a következőképpen néz ki (a DI Mendeleyev Periodikus Táblázatából vett relatív atomtömeg értékeit egész számra kerekítve):
x: y: z = ω (Na) / Ar (Na). ω (P) / Ar (P). ω (O) / Ar (O);
x: y: z = 34,6 / 23. 23,3 / 31: 42,1 / 16;
x: y: z = 1,5. 0,75: 2,63 = 2,13.
Ezért a nátrium, foszfor és oxigén kombinációjának képlete Na2P03 formájában van.