3. rész a kémiai termokémia és a kémiai kinetika az alap 6 termokémia absztrakt előadás
- 6.1. A kémiai reakciók termikus hatásai
Ключові терміни:
6.1. A kémiai reakciók termikus hatásai
Termokémia része úgynevezett kémiai termodinamika, amelyek alkalmazásával foglalkozik az első törvény kiszámításához a termikus hatások a különböző fizikai-kémiai folyamatok. Kémiai reakciók, fázisátalakulás, kristályosítási eljárások, oldódási stb gyakorlatban a legnagyobb érdeklődés van termokémiai számítások hőhatás a kémiai reakciók.
Standard képződési entalpia a hőmennyiség szabadul (exoterm reakció), vagy felszívódik (endoterm reakció), az irreverzibilis reakció játszódik le, csak akkor, ha a munka csak a munka bővítése.
Következésképpen a kémiai reakciók esetében a termodinamika első törvényének aránya
- [TEX] \ delta = dU + PdV [/ TEX], (6.1)
- itt [TEX] Q [/ TEX] a kémiai reakció termikus hatása,
- [TEX] \ delta = PdV [/ TEX] a rendszer által a reakció során végzett munka.
Standard képződési entalpia előforduló állandó térfogaton, nevezett izochor hőhatással és jelöljük [TEX] Q_ [/ tex]. Mivel ebben az esetben [TEX] PdV = 0 [/ TEX], akkor
Következésképpen a kémiai reakció termikus hatása állandó térfogatban megegyezik a rendszer belső energiájának változásával.
A reakció izobár termikus hatása [TEX] \ left (Q_\ right) [/ TEX] megtalálható a (6.1) egyenlet integrálásával:
A kémiai reakció izobárikus hőhatása megegyezik a rendszer entalpiájának változásával.
Így az izochorikus és izobárikus termikus hatások megegyeznek az állami funkciók változásaiban. Következésképpen nem függnek a folyamat útjától, hanem csak a rendszer kezdeti és végső állapotai határozzák meg. A reakciók termikus hatásainak függetlenségét az orosz tudós GI akadémikus állapította meg. Hess 1840-ben kísérleti adatok alapján.
A hesszi törvény
Hess törvénye megállapítja, hogy ha az adott forrásanyagból különböző módon kaphatják meg a meghatározott végtermékeket, akkor függetlenül a megszerzés módjától, a köztes reakciók számáról és típusáról, a teljes hőhatás minden útvonalon ugyanaz lesz.
Más szavakkal, a kémiai reakció termikus hatása csak a kiindulási anyagok és a reakciótermékek típusától és állapotától függ, és nem függ az átmenet útjától.
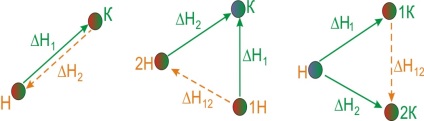
Nyissuk meg példákkal a Hess törvény értelmét. Mivel a kémiai reakciók leggyakrabban állandó nyomáson fordulnak elő, hőhatásukat az entalpia [TEX] \ Delta [/ TEX] változása jellemzi. Képzeljünk el egy átalakítási folyamat a kiindulási anyagok [TEX] A _ [/ tex], [TEX] A _ [/ tex], [TEX] A _ [/ tex]. a termékek, [TEX] B _ [/ tex], [TEX] B _ [/ tex], [TEX] B _ [/ tex]. és ez az átalakulás többféle módon valósítható meg:- Közvetlen reakció az A anyagok átalakításáról H-termikus hatású B anyagokra [TEX] \ Delta> [/ TEX].
- A reakció két lépcsőből áll, termikus hatásokkal [TEX] \ Delta> [/ TEX] és [TEX] \ Delta> [/ TEX].
- Egy sor reakciók termikus hatások [TEX] \ Delta> [/ tex], [TEX] \ Delta> [/ tex], [TEX] \ Delta> [/ tex], [TEX] \ Delta> [/ tex].
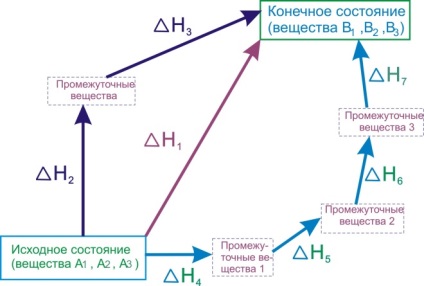
6.1 ábra - Hess törvényének ábrája
Hess törvénye kimondja, hogy ezek a termikus hatások a kapcsolat:
Hess törvényének gyakorlati jelentősége az, hogy lehetővé teszi számunkra az ilyen reakciók hőhatásainak kiszámítását, amelyekre közvetlenül nem lehet mérni. Például, a termikus hatás [TEX] \ Delta H_ [/ tex] reakció [TEX] C + 1/2 O_ = CO [/ tex] nem lehet direkt méréssel határoztunk meg, mint egyidejűleg ez a reakció mindig van egy reakció kialakulását [TEX] CO_ [/ TEX]. A [TEX] \ Delta> [/ TEX] meghatározásához a következő reakciók hőhatását használjuk:Hess törvénye szerint
A kémiai reakciók termikus hatásait mérni lehet, és kísérleti úton speciális kalorimetrikus műszerekben is elvégezhető. A pontos kalorimetriás mérések időigényesek és időigényesek. Ezért csak akkor hajtják végre őket, ha lehetetlen Hess törvényét alkalmazni.
A reakció termokémiai egyenleteinek írása során a reagensek összesített állapotát és a reakció termikus hatását jelzik:
Ilyen bejegyzés azt jelzi, hogy a reakció 1 mol gázalakú aceton [TEX] C_H_O [/ tex] 4 mól oxigén gázt nyerünk 3 mol gáz [TEX] CO _ [/ tex] és 3 mol folyékony víz. Így 1 mól acetonra 1817,0 kJ hőt szabadítanak fel.
Mivel hőhatás függ fizikai állapotát a reaktánsok és a feltételeket, amelyek mellett a reakció lejátszódik, majd a termokémiai számítások, hőhatás be a termokémiai egyenlet, kell tulajdonítani valamilyen azonos feltételek mellett, különben nem hasonlíthatók. Ilyen körülmények között megtörténnek azok a körülmények, amelyek között a reakció a szokásos állapotokban lévő anyagok között történik.
Az egyes folyékony és szilárd anyagok standard állapotát 298,15 K ([TEX] 25) hőmérsékleten tartják<^>C; [/ tex]), és a nyomás 101325 Pa és gázok - az ő állapotban, amikor nyomáson 101325 Pa, és hőmérséklete 298,15 K betartják a ideális gáz állapotegyenlet. Ezért, a reakcióhő standard körülmények között jelöli [TEX] \ Delta_ ^ 0 [/ tex] és [TEX] \ Delta_ ^ 0 [/ tex].Hess törvényéből következnek olyan következmények, amelyek nagy gyakorlati jelentőséggel bírnak.