1 hét
A biokémia fő feladata, hogy teljes molekuláris szintű megértést érjen el a sejtek aktivitásával kapcsolatos összes kémiai folyamat természetében. A probléma megoldásához a sejtek közül számos olyan vegyületet kell kiválasztani, amelyek ott vannak, meghatározták szerkezetüket és meghatározzák funkcióikat.
1.1.2. A biokémia és az orvostudomány között széleskörű kommunikáció áll rendelkezésre. A biokémiai kutatásoknak köszönhetően számos betegséggel kapcsolatos kérdésre válaszolhattak. Például:
A toxin hatásának tanulmányozása, amelyet a kolera okozó ágens okozott, segített a klinikai tünetek kialakulásának mechanizmusában (hasmenés, dehidráció), valamint a betegség kezelésére szolgáló módszerek kifejlesztéséhez.
A szúnyogok - a malária kórokozók hordozói - a malária elleni intézkedések kidolgozásakor figyelembe veszik a biokémiai rendszereket, amelyek biztosítják a rovarirtók elleni immunitást.
A tanulmány a diéta a grönlandi eszkimók, akik fogyasztanak nagy mennyiségű halolaj gazdag többszörösen telítetlen zsírsavakban néhány, ritkán atherosclerosisban szenvedő, elvezetett gondolni ezeknek a használata zsírsavak csökkentik a koleszterin-tartalom a vérplazmában.
Másrészt az egyes betegségek okainak és fejlődési irányának tanulmányozása új biokémiai területek létrehozásához vezetett:
az angol orvos Archibald Garrod észrevételei a veleszületett anyagcsere-rendellenességekben szenvedő betegek számára ösztönözte az anyagcsere-utak vizsgálatát, amelyek megsértése ilyen körülmények között fordul elő.
tanulmány a biokémiai folyamatok betegeknél familiáris hiperkoleszterinémia, kialakulásához vezető súlyos atheroszklerózis korai életkorban, hozzájárult ahhoz, hogy adatokat szerezzen a sejt-receptorok és mechanizmusai koleszterin felszívódását a sejtek.
A rosszindulatú tumorsejtek anyagcseréjének intenzív vizsgálata érdeklődést keltett a sejtek növekedésének és sokszorozásának szabályozására szolgáló molekuláris mechanizmusokban.
Tanfolyamunk tanulmányozása során további példákat mutat be a biokémia és az orvostudomány közötti szoros kölcsönhatásról.
1.2.1. A vizsgálat fő célja a metabolizmus - az összes kémiai reakció összesített a sejtben. Mindezeket a reakciókat, kis kivétellel, speciális fehérjék, enzimek katalizálják. Annak érdekében, hogy megértsük az anyagcsere-reakciók mechanizmusát, lehetetlen az enzimek működésének sajátosságairól, szabályozásuk mechanizmusairól. Az enzimek tulajdonsága és hatásmechanizmusa kémiai természetüknek köszönhető. Ezért a biokémia tanfolyamának tanulmányozása hagyományosan megkezdődik a fehérjék szerkezetének és működésének áttekintésével.
1.2.2. Amint az a szerves kémia folyamatából ismeretes, valamennyi fehérje monomerekből - a-aminosavakból áll, amelyek általános képleteik:
,
ahol R jelentése egy gyök vagy egy oldallánc.
A fehérjéket alkotó aminosavak esetében a következő közös tulajdonságok jellemzőek:
mindegyikük a-aminosav. A szervezetben vannak olyan aminosavak is, amelyeknek a gyökök eltérő elrendezése van, de nem részei a fehérjéknek;
mivel minden aminosav (glicin kivételével) α-szénatom, amelyhez négy különböző szubsztituens, akkor ez az atom aszimmetrikus és aminosavak optikai aktivitás (a képesség, hogy forgassa el a polarizált fény síkját az egyik vagy másik irányba);
Az aszimmetrikus szénatomot tartalmazó aminosavak az L-sztereokémiai sorozathoz tartoznak. A testfehérjékben nincsenek aminosavak D-izomerjei;
Semleges vizes oldatokban az aminosavak bipoláris ionok (zwitter ionok) formájában, és mind a savas, mind az alap tulajdonságokkal rendelkeznek.
Az egyes aminosavak egyedi tulajdonságait a radikális szerkezet határozza meg. Ismételjük meg a 20 fehérje aminosav formulait (1.1. Ábra) és azok rövidítéseit (1.1. Táblázat).
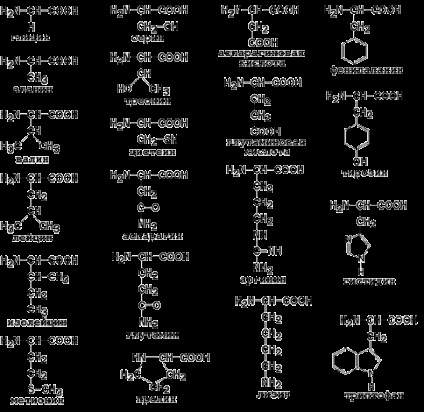
1.1. Ábra. Az aminosavak képletei.
1.2.3. A fehérje aminosavak a radikális polaritásuk alapján osztályozhatók. Ezek a következő csoportokra bonthatók: (1.2. Ábra).
1.3.1. Az azonos vagy különböző aminosavak két molekulája kovalensen kötődhet egymáshoz egy szubsztituált amidkötéssel, amelyet peptidkötésnek neveznek. A peptidkötést az egyik aminosav a-karboxil-csoportjából származó -OH csoport és a másik aminosav a-amino-csoportjából származó hidrogénatom hasításával állítjuk elő. A peptidegység merev szerkezetű. Mind a négy atom egy síkban helyezkedik el, és az NH csoport hidrogénje a karbonilcsoport oxigénjéhez viszonyítva transzpozíciót foglal el. A szén- és nitrogénatomok közötti kötés részben kettős kötés, és ennek a kapcsolatoknak a forgása nehéz. Ugyanakkor a peptidegység mindkét oldalán nagyfokú forgási szabadság van a C-Ca és Ca-N kötésekhez képest.
1.3.2. Az aminosavak peptidkötésekkel képesek polipeptidláncokat létrehozni. A polipeptidláncban levő aminosavak szekvenciáját a protein primer struktúrájának nevezik. A peptidek kis számú aminosav egységben különböznek a fehérjéktől. Így a peptidkötést tartalmazó két aminosav kölcsönhatásának terméke dipeptidnek, három aminosav tripeptidnek, négy tetrapeptidnek stb. Az emberi szervezetben peptidek alakulnak ki rendszerint a fehérjék részleges hidrolízisével. Ezen peptidek közül soknak nagy a biológiai aktivitása, például a vazopresszin, az oxitocin, a bradykinin, a tioleoliberin. enkefalinok.
A peptid vagy fehérje aminosav egységeit aminosavmaradékoknak nevezzük. A szabad a-aminocsoportot tartalmazó aminosav N-terminálisnak nevezzük, és a szabad karboxilcsoportot tartalmazó maradék C-terminális. A peptidek szerkezeti képleteit feljegyezzük és olvassuk az N-terminálisból. A polipeptidet alkotó összes aminosavmaradék (a C-terminális kivételével) az -in helyett a -il helyett véget ér. A polipeptidláncok aminosavainak megjelöléséhez három betűs rövidítést használnak a hazai irodalomban (1.1. Táblázat).

1. ábra Példa egy peptidre.
1.3.3. Tanulja meg, hogyan kell írni a peptidek szerkezeti képletét. Ne feledje, hogy a peptideket írják és olvassák az N-terminusból. Először a peptid gerinc szerkezetét írja le, például:
a tetrapeptidhez és így tovább.
Ezután az a-szénatomokhoz oldószereket adunk, például a fenil-lfenil-tripeptidet a következőképpen jegyezzük fel:
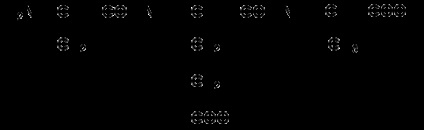
Bizonyos nehézségeket a prolinmaradványokat tartalmazó peptidek írása okoz. Ebben az esetben figyelembe kell venni, hogy a prolingyök nem csak az a-szénatomhoz kapcsolódik, hanem az a-aminocsoportban lévő hidrogénatomot is helyettesítheti. Például a peptid tre-gly-pro-t az alábbiak szerint jegyezzük fel:
1.3.4. Tanuld meg, hogy adjon nevet a peptideknek. Vegye figyelembe, hogy az összes aminosav-maradékok, amelyek részei a polipeptid (kivéve a C-terminális), már a véget -in-csoport helyett (1.1 táblázat) Megjegyzendő, hogy a neve a maradékok bizonyos aminosavak keletkeznek nem mint általános szabály.
1.3.1. Az azonos vagy különböző aminosavak két molekulája kovalensen kötődhet egymáshoz egy szubsztituált amidkötéssel, amelyet peptidkötésnek neveznek. A peptidkötést az egyik aminosav a-karboxil-csoportjából származó -OH csoport és a másik aminosav a-amino-csoportjából származó hidrogénatom hasításával állítjuk elő. A peptidegység merev szerkezetű. Mind a négy atom egy síkban helyezkedik el, és az NH csoport hidrogénje a karbonilcsoport oxigénjéhez viszonyítva transzpozíciót foglal el. A szén- és nitrogénatomok közötti kötés részben kettős kötés, és ennek a kapcsolatoknak a forgása nehéz. Ugyanakkor a peptidegység mindkét oldalán nagyfokú forgási szabadság van a C-Ca és Ca-N kötésekhez képest.
1.3.2. Az aminosavak peptidkötésekkel képesek polipeptidláncokat létrehozni. A polipeptidláncban levő aminosavak szekvenciáját a protein primer struktúrájának nevezik. A peptidek kis számú aminosav egységben különböznek a fehérjéktől. Így a peptidkötést tartalmazó két aminosav kölcsönhatásának terméke dipeptidnek, három aminosav tripeptidnek, négy tetrapeptidnek stb. Az emberi szervezetben peptidek alakulnak ki rendszerint a fehérjék részleges hidrolízisével. Ezen peptidek közül soknak nagy a biológiai aktivitása, például a vazopresszin, az oxitocin, a bradykinin, a tioleoliberin. enkefalinok.
A peptid vagy fehérje aminosav egységeit aminosavmaradékoknak nevezzük. A szabad a-aminocsoportot tartalmazó aminosav N-terminálisnak nevezzük, és a szabad karboxilcsoportot tartalmazó maradék C-terminális. A peptidek szerkezeti képleteit feljegyezzük és olvassuk az N-terminálisból. A polipeptidet alkotó összes aminosavmaradék (a C-terminális kivételével) az -in helyett a -il helyett véget ér. A polipeptidláncok aminosavainak megjelöléséhez három betűs rövidítést használnak a hazai irodalomban (1.1. Táblázat).

1. ábra Példa egy peptidre.
1.3.3. Tanulja meg, hogyan kell írni a peptidek szerkezeti képletét. Ne feledje, hogy a peptideket írják és olvassák az N-terminusból. Először a peptid gerinc szerkezetét írja le, például:
a tetrapeptidhez és így tovább.
Ezután az a-szénatomokhoz oldószereket adunk, például a fenil-lfenil-tripeptidet a következőképpen jegyezzük fel:
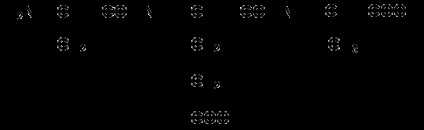
Bizonyos nehézségeket a prolinmaradványokat tartalmazó peptidek írása okoz. Ebben az esetben figyelembe kell venni, hogy a prolingyök nem csak az a-szénatomhoz kapcsolódik, hanem az a-aminocsoportban lévő hidrogénatomot is helyettesítheti. Például a peptid tre-gly-pro-t az alábbiak szerint jegyezzük fel:
1.3.4. Tanuld meg, hogy adjon nevet a peptideknek. Vegye figyelembe, hogy az összes aminosav-maradékok, amelyek részei a polipeptid (kivéve a C-terminális), már a véget -in-csoport helyett (1.1 táblázat) Megjegyzendő, hogy a neve a maradékok bizonyos aminosavak keletkeznek nem mint általános szabály.
1. Triptofán és lizint tartalmazó aminosavak keveréke. papírkromatográfiával választottuk le. Az alábbi aminosavak közül melyik a kromatogram megnyilvánulása után lesz a legtávolabb a kiindulási ponttól?
2. A fehérje peptidek részleges hidrolízisével a következőket nyerjük: a) tir-ser-arg-asp és b) met-pro-asp-lei. Melyik ezek közül a peptidek jobban oldódnak vízben?
3. Mely közegben (savas, lúgos, semleges) a peptidek izoelektromos pontja: a) ala-val-lys-fen; b) cisz-glu-tri-met
4. Milyen irányban (a katódhoz, az anódhoz) a 7,0 pH-értékű elektromos mezőben mozoghat: a) arg-gly-ala-val; b) leu-asp-glu-tir
5. 9 aminosavmaradékot tartalmazó peptidet kétféleképpen hidrolizáltak. A következő peptidcsoportokat találtam a hidrolizátumokban:
pro-tre-GIS; Asp-Ser-cisz; Tyr-Gly-Arg;
GIS-forgatás; cisz-Pro-Thr; Gly-Arg; Asp-Ser.
Határozzuk meg a szülő peptid aminosavszekvenciáját.
1.5.2. A döntés standardjai.
1. A triptofán távolabb lesz a kiindulási ponttól, mivel ez az aminosav egy hidrofób gyököt tartalmaz és szerves oldószerben - mobil fázisban jobban oldódik papírkromatográfiával (lásd 1.2).
2. A tir-ser-arg-asp peptidben a négy aminosavmaradék hidrofil; a met-pro-asp-lei peptidje egy hidrofil és két hidrofób aminosav-maradékot tartalmaz. Ezért az első peptid jobban oldódik a vízben (lásd 1.4).
3. a) Az ala-val-lys-fen peptid pozitív töltésű aminosavat tartalmaz; következésképpen a peptid izoelektromos pontja a lúgos közegben van;
b) A cisz-glu-tri-met-peptid negatív töltésű aminosavat tartalmaz, így ennek a peptidnek az izoelektromos pontja savas közegben van (lásd 1.4).
4. a) Az arg-gly-ala-val peptid összetétele egy pozitív töltésű gyököt tartalmaz, ezért egy 7,8 pH-értékű elektromos mezőben ez a peptid a katódra költözik;
b) A leu-asp-glutiszta peptid két negatív töltésű aminosav-maradékból áll. Így ez a pepiid egy elektromos mezőben az anódra költözik (lásd 1.4).
5. A probléma megoldásához az első peptidkészletben meg kell találni azokat, amelyekben az aminosavak szekvenciája részben egybeesik a második csoport peptidjeiben levő aminosavszekvenciával. Ez lehetővé teszi számunkra, hogy meghatározzuk, mely peptidkötések vannak a szülőpeptidben hidrolizálva. Így az első csoportban vannak pro-tre-gis és asp-ser-cis peptidek; a második csoportban - peptid cisz-pro-tre. Következésképpen a szülőpeptidben a cisz- és pro-aminosavak között kötés volt, és tartalmazta az asp-sery-cisz-pro-piaci fragmentumot. A peptidek második csoportjában van egy dipeptid gigit, az első esetben ezek az aminosavak a különböző tripeptidek részei. Ezért a kezdeti peptidben ezeknek az aminosavaknak a kötődése volt, és az alábbi szerkezete volt: asp-sery-cis-pro-tre-gis-tiir-gly-arg.