Triton x-100 Tween-20 tisztítószerek és mások
1. táblázat A mosószerek osztályozása.
A detergensek szerves vegyületek, amelyek egy hidrofób szénhidrogén-fragmensből és egy hidrofil töltésű fejcsoportból állnak (1A. Ábra). Amikor vízben oldjuk egy bizonyos koncentráció és hőmérséklet a detergens molekulák micellákat képeznek a hidrofób része a micella, és a fejen belül csoportban a külső (ábra. 1B). Így a micella hidrofób magja megköti a fehérjék hidrofób régióit. A detergens mennyisége molekulák a micella aggregációs számot hívják, ami egy fontos paraméter értékeléséhez használt oldhatóságának membránfehérjék [2]. A hossza a hidrofób rész egyenesen arányos a hidrofób jelleget, és meglehetősen állandó különböző mosószerek, mivel a töltött fej csoport változó, és, kezdve annak jellemzőit, mosószerek három csoportba sorolhatók: ionos (anionos vagy kationos), zwitterionos vagy nemionos. A minimális detergenskoncentrációt, amelynél a micellákat egy adott hőmérsékleten kimutatják, kritikus micellás koncentrációnak (CMC) nevezik. A KMC alatti koncentrációnál csak monomereket figyeltek meg; a CMC feletti koncentrációkban a micellák és monomerek együtt más, nem micelláris fázisokkal vannak jelen, amelyek nem oldódnak vízben. Ezenkívül az alacsony hőmérséklet, amelynél a micellák formáját kritikus micelláris hőmérsékletnek (KMT) nevezzük. Így, a hőmérséklet és a koncentráció fontos paraméterek a fázis elválasztó és oldhatóságát mosószer. CMC is függ, hogy milyen mértékben lipofilitása a szülő csoport. Rendszerint az alacsony lipofilitás vagy lipophobia magas CMC-t eredményez.
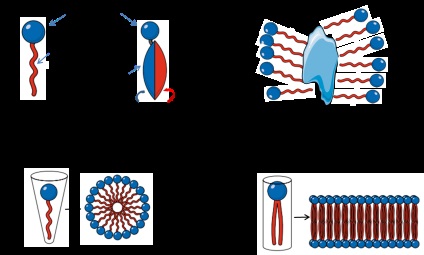
1. ábra A detergens monomerek általános szerkezete. Alkalmazott Anatrace-ből.
Az ionos mosószerek egy hidrofób láncból és egy feltöltött fejcsoportból állnak, amely lehet egy anion vagy egy kation. Rendszerint magasabb CMC-értékkel rendelkeznek, mint a nem ionos mosószerek. Ezek a mosószerek erősebbek.
nátrium-dodecil-szulfát (SDS) - anionos SDS igen hatásos felületaktív anyag kolloid feloldódását szinte bármilyen fehérje. Tönkreteszi a fehérjék nem kovalens kötéseit, ezáltal denaturálódást okozva, ami a natív konformáció és funkció elvesztéséhez vezet. SDS kötődik a fehérje tömegaránya 1,4: 1 (vagy egy anion SDS-két aminosav), és ezért maszkok a felelős a fehérje is, amely egy negatív töltést ad az összes fehérje a mintában, annak ellenére, hogy az izoelektromos index (Pl). Ez a fő oka annak, hogy széles körben elterjedt az SDS-elektroforézis denaturálásával poliakrilamid gélben (SDS-PAGE). Jellemzően, a teljes sejtlízis az SDS jelenlétében, a mintát kell homogenizáljuk ultrahanggal végzett kezelés (alávetni ultrasonikatsii) és többször átbocsátjuk egy tűt (19G), hogy a DNS degradációt. Mivel az SDS okoz fehérjék denaturálása és elpusztítja a háromdimenziós szerkezet, ez nem használható olyan esetekben, amikor a kívánt aktív fehérjék vagy tanulmányozására fehérje-fehérje kölcsönhatások. További óvintézkedéseket kell eljárni, amikor ionos detergensek, mert azok egyes tulajdonságai eltérhetnek pufferoldatokat változó ionerősség (például CMC esik 0,5 mmol 8-növelésével a NaCl koncentráció 0 és 500 mmól). Továbbá, SDS-t kicsapjuk alacsony hőmérsékleten, mivel az egyik legmagasabb a KMT mosószerek, és ezt a hatást fokozza jelenlétében káliumsók. Ezt a jelenséget SDS-ből származó protein-minta tisztítására használhatjuk [3].
Feltöltött poláris fejcsoportjaik miatt ionos mosószerek nem távolíthatók el ioncserélő kromatográfiával.
A nemionos mosószerek különböznek az ionos detergensektől, mivel fejcsoportjuk nem töltődik és hidrofil. Lágy felületaktív anyagoknak tekintendők, mivel elpusztítják a fehérje-lipid és az interlipid, de nem a protein-fehérje kölcsönhatásokat, és a legtöbbjük nem okoz proteint denaturálódást. Így a fehérjék feloldhatók és izolálhatók természetes és aktív formájukban, miközben megtartják a fehérje kölcsönhatásokat. Ez a fő előnyük, és előnyben részesítik a membránfehérjék izolálását.
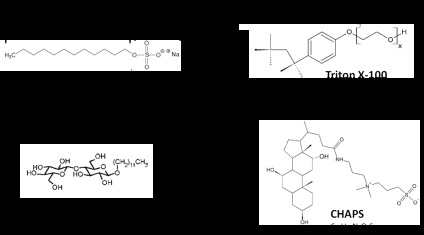
2. ábra A leggyakrabban használt detergensek szerkezete és képletei G-Biosciences-ből adaptálva.
A Triton X-100 a nem-ionos felületaktív anyag legegyszerűbb példája, amely a legtöbb kísérlet esetében előnyös az immunprecipitáció alkalmazásával. Minden e csoport tagjai (Triton X100, Triton X114, Nonidet P40, Igepal ® CA-630) nagyon hasonló, és csak különböznek az átlagos száma (N) a monomerek a micella (9,6, 8,0, 9,0 és 9,5, -kal), és a PEG méretének fej csoportok [4] .Triton X100 egy származéka polioxietilén alkilfenil egy hidrofób csoport. A KMC értéke alacsony, ezért a Triton X-100 nem távolítható el dialízissel. A csapadékképződés hőmérséklete 64 ° C, és ezen a hőmérsékleten megfigyelhető a fázisszétválás.
N-dodecil-β-D-maltozid (DDM) jelentése egy glikozid felületaktív széles körben használt kitermelése hidrofób és a membrán fehérjék, igénylő esetekben a az aktivitás megtartása mellett. Hatékonyabb, mint más felületaktív anyagok, például CHAPS vagy NP-40 [5]. Glikozidos lánc lipofil helyek, magas CMC (0,17 mmol), és a belső felülete a micellák létrehoz egy víz-szerű mikrokörnyezetet ideális oldódását a kolloid stabilitást, és a megőrzése membránok és hidrofób proteinek.
A digitonin purple digitalis-ból (Digitalis purpurea) származik, amelyet eukarióta plazmamembránokra használnak. A Sarkozil és a Triton X-100 képes belső, de nem külső bakteriális membránra szolubilizálni.
A Tween-20 és Tween-80 poliszorbát felületaktív anyagok, amelyek egy zsírsav-észterből és egy hosszú poli (oxi-etilén) láncból állnak. Nagyon alacsony CMC-t tartalmaznak, és rendszerint enyhe felületaktív anyagok, nem befolyásolják a fehérje aktivitását, és hatásosak a szolubilizáció szempontjából. Ezek az összetevők gyakran nem puffer oldatok lízisére sejtek és a normális alkalmazások, mint detergensek, amelyek immunoblot és ELISA, mivel azok segítik, hogy minimalizáljuk a nem-specifikus ellenanyag-kötődés és eltávolítását a nem kötött fragmentumok.
A legtöbb nemionos mosószer zavarhatja az ultraibolya (UV) spektrofotometriát, különösen a Triton X100-at, mivel tartalmaznak egy fenilgyűrűt és UV fényt szívnak fel. Így a fehérje 280 nm-en történő azonosítása pontatlan lesz.
Az ikerionos vagy amfoter detergensek fejcsoportjai hidrofilek és pozitív és negatív tölteteket tartalmaznak egyenlő mennyiségben, így semleges teljes töltetet eredményeznek. Általában szigorúbbak, mint a nemionos felületaktív anyagok. Az ikerionos vagy amfoter detergensek tipikus példája a 3 - [(3-kolamido-propil) -dimetil-ammonio] -1-propánszulfonát, amely CHAPS néven ismert. Magas KMC-értéke (6 mmol szobahőmérsékleten) hatékonyan eltávolítható dialízissel. Ezt gyakran az izoelektromos fókuszálás és a 2D-elektroforézis esetében 2-4% -os koncentrációban alkalmazzák. A CHAPSO különbözik a CHAPS-től, hogy egy polárisabb fejcsoportot tartalmaz, ami jobban oldhatóvá teszi. Így főleg az integrált membránfehérjék kolloidális feloldódására alkalmazzák.
Kaotróp ágensek, mint a felületaktív anyagok, hogy azok megzavarják nem kovalens kölcsönhatások (hidrogénkötések, dipólus-dipólus kölcsönhatások, hidrofób kölcsönhatások), elősegítve a fehérje, amely ebben az esetben általában reverzibilis. Karbamid önmagában vagy kombinációban tiokarbamiddal vagy más detergensek, a leggyakrabban használt kaotropok 2D-gélelektroforézissel és enzimatikus hasítása fehérjék oldat proteomikai áramlási folyamatokat. A karbamid használatakor ügyelni kell arra, hogy a minták felmelegedése elkerülhető legyen 37 ° C felett, mivel ez fehérjék karbamilezéséhez vezet [6].
Mosószerek membránfehérjék izolálásához
A membránfehérjék izolálása érdekes, de bizonyos nehézségekkel jár a citoszol és nukleoplazmatikus fehérjék felszabadulásához képest. Ennek fő okai a nehéz, az oldhatósági vizes oldatok, a komplex szerkezete a lipid réteg és azok a hidrofil és hidrofób tartományok, és az alacsony szintű expresszió. A membránfehérjék feloldásához magas CMC-t tartalmazó detergenseket kell kiválasztani. A pufferoldat térfogata szintén fontos, mivel elegendő mennyiségű detergensre van szükség a minta összes membránfehérje feloldásához. Linke szerint [2]. A lipidmembrán környezet megfelelő szimulálásához legalább egy micella per membránfehérje szükséges (1C-D. Ábra). Elvileg, a hőmérséklet változtatásával és a só koncentrációja a puffer-oldat hatékony oldódását membránfehérjék érhető el fázisszétválást. Ebben az esetben a micellákkal körülvett membránfehérjék kicsapódnak a detergenssel, és az oldható fehérjék a felülúszóban maradnak. Az a hőmérséklet, amelyen a mosószer két fázisra oszlik, a felhőpontnak nevezzük. Amellett, hogy a hőmérséklet, a zavarosodási pont függ adalékanyagok pufferoldatban, mint a glicerin vagy a sók (például, Triton X114 zavarosodási pontja 23 ° C, de jelenlétében 20% glicerin, a zavarosodási pont csökken 4 ° C). Ez nagyon fontos, ha a fehérje stabilitását magas hőmérsékletnek tesszük ki.
Egy jó detergensnek lizálnia kell a sejteket, fel kell oldania a fehérjéket és alkalmasnak kell lennie a későbbi eljárásokhoz. Az oldható fehérje natív vagy denaturált formában történő megválasztása a második kérdés, amelyre válaszolni kell. Nincs olyan ideális mosószer, amely minden alkalmazásra alkalmas, és ugyanabban az alkalmazásban az eredmény az érdekelt fehérjétől függően változik (2. táblázat). Így a próba és a hiba itt a legjobb stratégia, és a különböző mosószereket meg kell vizsgálni. Ezenkívül a hidrolízis és az oxidáció elkerülésére a legjobb gyakorlat a friss mosószeres munkaoldat elkészítése.