Az immunológia túlérzékenységének hatékony fázisa
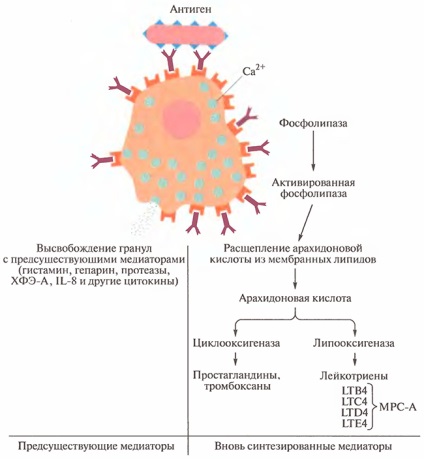
Ábra. 14.4. Közvetítők szabadulnak fel, amikor a hízósejtek aktiválódnak
Korábban létező neurotranszmitterek Hisztin
A hisztamin a sejtekben a hisztidin aminosavának dekarboxilezésével van kialakítva, és elektrosztatikus kölcsönhatásba kerül a savas heparinmátrix fehérjével. A felszabadulás után a hisztamin gyorsan kötődik a különböző típusú sejtekben jelen lévő két fő receptor típushoz (H1 és H2), és meghatározza a különböző hatások kifejlődését. Ha a simaizom H1 receptorokhoz kötődnek, a hisztamin összehúzza őket; amikor a hisztamin az endoteliális sejtek H1 receptorához kötődik, a kontaktusok helyén levő kapcsolódáshoz vezet, ami növeli az érpermeabilitást. A H2 receptorok szerepet játszanak a nyálkahártya szekréciójának fokozásában és a vaszkuláris permeabilitás növelésében, valamint a gyomornyálkahártya savának kiválasztásában.
Mindezek a hatások felelősek néhány főbb szisztémás anaphylaxis tünetek: légszomj (asztma), vagy a fulladás okozta bronchiális simaizom összehúzódást, és vérnyomásesés miatt előfordul, hogy a folyadékkivezető nyílás a hajók szöveti terek, mivel a permeabilitási véredények növekszik. H1-receptorok blokkolása antihisztaminokkal, mint Benadryl, közvetlenül versenyben hisztamin.
Amikor ezeket a gyógyszereket gyorsan elviszik, képesek ellenállni a hisztamin hatásainak. A H2-receptorok blokkolásához más gyógyszereket, például cimetidint használnak. Azonban az antihisztaminok alkalmazása azt mutatta, hogy nem akadályozzák meg a simaizmok összehúzódását, ami később jön létre, és ellenállóbb, mint a hisztamin okozta. Ez a megfigyelés az anafilaxiás lassan reagáló anyagok (MPC-A) felfedezéséhez vezetett. most leukotriéneknek nevezik.
A szerotonin csak bizonyos állatokban, például rágcsálókban jelen van a hízósejtekben. A hatása hasonló a hisztamin hatásához, azaz ez csökkenti a simaizmokat és növeli az edények átjárhatóságát
Citokinek és kemotaxis faktorok
A hízósejt degranulálása után számos citokin és kemotaxis faktor szabadul fel, például citokinek, például GM-CSF, IL-5 és TNFa. Az alacsony molekulasúlyú peptideket, amelyeket az eozinofilok kemotaktikus faktorának (CFE) is neveznek, szintén felszabadulnak. Ez olyan kemotaktikus gradienset hoz létre, amely vonzza az eozinofileket a helyszínre. Ezenkívül a gyulladásos zónában a sejtek kemotaxisát fokozzák a késői fázisú mediátorok: a vérlemezke-aktivációs faktor (FAT) és a leukotriének.
A gyulladás helyén vonzódó egyéb fontos sejtek neutrofilek. Ezeknek a PMN-granulocitáknak a kemotaxisa az IL-8 aktivált hízósejtektől való felszabadulására reagál. A granulociták fontos szerepet játszanak az IgE által közvetített túlérzékenység késői fázisában. A hízósejtek által a hízósejtek felszabadulására adott válaszként a gyulladás helyére vonat- kozó egyéb sejtek a bazofilek, makrofágok, vérlemezkék és limfociták.
Allergiás reakciókban az eozinofilek az IgE által közvetített reakciók indikátora, különösen a késői fázis, az alábbiakban tárgyaltak. Aril-szulfatázt és hisztamint is felszabadíthatnak, amely elpusztítja a túlérzékenységi reakció néhány közvetítőjét, és ezáltal egyike a reakciók korlátozásának. Az eozinofilek védő funkciót is végeznek a parazita fertőzésekben.
A heparin egy savas proteoglikán, amely granulátummátrix, amelyhez a fő mediátorok, például a hisztamin és a szerotonin kapcsolódnak. Savas természete határozza meg az oszlopcellák metakromatikus tulajdonságait (intenzív festés) lúgos festéssel, például toluidin kékkel. A heparin felszabadulása a véralvadás gátlásához vezet, ami fontos lehet az emésztő sejt későbbi helyreállításában, vagy az antigén további bejutása a reakció-régióba; A heparin azonban nem közvetlenül határozza meg az anafilaxiás tünetek megjelenését.
Az újonnan szintetizált közvetítők
leukotriének
Amikor a hisztamint a tengerimalac méhüregéből simaizomzattal kezelik, gyors összehúzódást észlelnek. Mint korábban jeleztük, ez a jelenség eredetileg az MRS-A számlához kapcsolódott. Napjainkban ismert, hogy az MPA-A peptidek egy sor peptidből állnak, amelyeket az arachidonsav metabolitja, leukotriének (LT) neveznek. A leukotriéneket LTB4, LTC4, LTD4 és LTE4-nek neveztük el. Kis mennyiségben a simaizmok tartós összehúzódását okozzák. Úgy gondolják, hogy az emberi leukotriének meghatározzák az antihisztaminokkal szemben rezisztens asztma fő megnyilvánulásait.
Thromboxánok és prosztaglandinok
A leukotriének alkotják csak egy kis része egy komplex rendszer előállított anyagok arachidonsavból foszfolipáz lipidekből a sejtmembrán aktiváláskor a hízósejtek. Az arachidonsav egy többszörösen telítetlen, hosszú láncú szénhidrát, amely oxidálható két különböző módon (lásd 14.4 ..), melyet lipoxigenáz hogy kialakítjuk a korábban leírt és a leukotriének által ciklooxigenáz termelni prosztaglandinok és tromboxánok. Sok tromboxánok vazoaktív anyagok, amelyek szintén okozhat hörgők és rendelkeznek kemotaktikus tulajdonságokat számos típusa ellen a leukociták, mint a neutrofil, eozinofil, bazofil és monociták.
A vérlemezke aktiválásának tényezője
A thrombocyta aktivációs faktor a thrombocyta aggregációt és a benne lévő mediátorok felszabadulását idézi elő, ilyen például a szövettan, valamint bizonyos fajok és szerotoninok. A vérlemezkék aktiválása az arachidonsav metabolitjainak felszabadulásához is vezethet, ezáltal javítva a hízósejtek által előidézett hatást. A FAT hatása önmagában a bronchokonstrikció és az értágulat egyik fő oka. Gyorsan és nagyon kis adagokban a sokkhoz hasonló tüneteket okoz.
A késői fázis reakciója
Ahogy az előzőekben említettük, számos különböző anyagot, szabadul fel az aktiváló hízósejtek és azok degranulációját felelősek a kifejezettebb gyulladásos reakció infiltráció és az eozinofilek felszaporodása, neutrofilek, bazofilek, limfociták és makrofágok. Ezek között a sejtek között elterjedt az eozinofil és a neutrofil. Ezek a legfontosabb sejtek aktiválódnak és fokozzák a gyulladást. Ez a reakció 48 órán belül gyakran következik be, és több napig is eltarthat. Ezt a késõi fázisú reakciónak nevezik, és a 3. ábrán látható. 14.5.
Az hízósejtek térhálósodnak IgE-vel egy antigénnel a felszínén, felszabadítva az Eozinofilok kemotaktikus faktort (CFE-A). amely vonzza az eozinofileket a reakcióhelyre. Átmenetet, valamint más leukociták véráramból a szövetbe való átvitelét elősegíti a hisztamin és más mediátorok által okozott megnövekedett vascularis permeabilitás. Különböző citokinek, mint például a GM-CSF, IL-3, IL-4, IL-5 és IL-13 fontos, mint a növekedési faktorok és differenciálódási eozinofilek, és az adhéziós bizonyos sejttípusok.
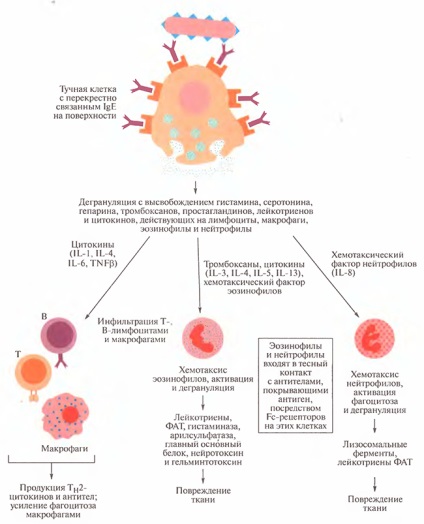
Ábra. 14.5. Az IgE által közvetített I. típusú túlérzékenység késői fázisú reakciója és néhány benne résztvevő mediátor
Együtt, ezek a gyulladásos mediátorok hosszan tartó perzisztáló ödéma megjelenését eredményezik, és a simaizom összehúzódásának második hulláma keletkezik, amely azonban kevésbé hangsúlyos, mint azonnali reakció esetén. A szenvedő személyek allergiás asztma, késői fázisú reakció kialakulásához vezet az egyik bíboros jelek az ilyen típusú asztma, nevezetesen a bronchiális hiperreaktivitás válaszul nem specifikus stimulusok, mint például a hisztamin és a metakolin.
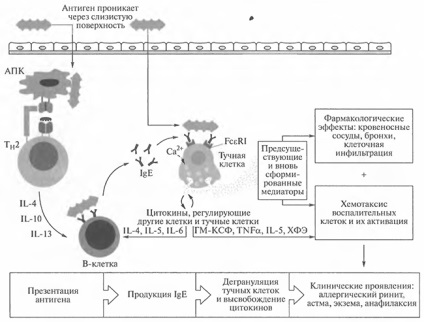
Ábra. 14.6. Az I. típusú túlérzékenység indukciós és effektor mechanizmusainak általános elgondolása
Az eozinofilek IgE-hez kötődhetnek az IgE (FceRII vagy CD23) alacsony affinitású Fc-receptorainak expressziójával is. Fc-receptorokat is expresszálnak az IgG Fc-fragmenséhez. Így az IgE és IgG által társított antigének az eozinofilek megfelelő Fc-receptoraihoz kötődnek, ami aktiválja ezeket a sejteket. A hízósejtekhez hasonlóan, az eozinofil-aktiváció után, a simaizmok összehúzódását okozó leukotriének degranulációja és felszabadulása következik be.
Az eozinofilek szintén felszabadítják a PAH-ot és a fő bázikus fehérjét (GOB). Ez a fehérje elpusztítja a különböző parazitákat (például a cisztoszómákat), megzavarja a mozgás képességét és a felület károsodását, továbbá a GOB mérgező hatást fejt ki az emlősök légzőrendszerének epitheliumára. Végül az eozinofilek degranulációjával az eozinofilok kationos fehérje szabadul fel - az aktív neurotoxin és a helminthotoxin. Mindezek a biológiailag aktív anyagok, amelyek hatékonyak a külföldi mikroorganizmusok elleni küzdelemben, szintén károsíthatják saját szövetüket.
A kemotaktikus faktorok által a reakcióhelyre vonzott neutrofilek szoros kapcsolatban állnak az antitestekkel bevont antigénnel, IgG-re épülő Fc receptorokon keresztül, amelyek ezeken a sejteken expresszálódnak. Ennek megfelelően ezek a sejtek aktiválódnak az immun antigén-antitest komplexek fagocitózisához. Ugyanakkor az aktív lizoszomális enzimek felszabadulnak tőlük, ami szövetkárosodást okoz. Az eozinofilok degranulációjához hasonlóan a neutrofilok degranulációjának termékei szintén leukotriének és PAP-k. Később a limfociták (mind a T-, mind a B-) behatolnak a reakciózónába, valamint makrofágokba, amelyek megvédik a szervezetet idegen antigénektől vagy mikroorganizmusoktól.
Az 1. ábrán. A 14.6 ábra mutatja az allergiás reakciók fejlõdésének legfontosabb mechanizmusát. Ugyanazok az események, amelyeket az IgE okoz és közvetít, akkor is előfordulnak, amikor a paraziták megszűnnek. Sajnos ugyanezek az események előfordulnak egyes emberekben, amikor az antigén ártalmatlan anyag, például a pollen, az állati szőr vagy a háztartási porból származó atkák, ami károsítja a szervezet saját szöveteit.
Az allergiás reakciók klinikai vonatkozásai
Klinikai hatásai allergiás válaszok lehet helyhez (allergiás rhinitis, asztma, atópiás bőrgyulladás és az ételallergia), szisztémás és súlyos, életet veszélyeztető reakciók (anafilaxia). Fontos megjegyezni azonban, hogy az asztmás reakció, amelyet még lokalizáltnak is neveznek, végzetes lehet. A hízósejtek degranulációja az egyes reakciók központi kapcsolata.
Allergiás rhinitis
Az allergiás nátha (gyakran szénsavas láz) a leggyakoribb atópiás rendellenesség. Ennek oka az, hogy a légúti allergének reagálnak az orrjáratokban és kötőhártyákban IgE-vel szenzitizált hízósejtekkel. A hízósejtek által kibocsátott mediátorok növelik a kapilláris permeabilitást, és helyi vasodilatációt okoznak, ami tipikus tünetekhez vezet, mint például tüsszögés és köhögés.
Élelmiszer-allergia
Az ételallergia egy másik gyakori atopiás rendellenesség, amelyet egy bizonyos termék okoz (pl. Földimogyoró, rizs, tojás). Ha allergiás termékek allergiásak, az allergen-specifikus IgE keresztkötése az alsó és felső emésztőrendszeri hízósejteken található. A hízósejtek degranulációja és a mediátorok felszabadulása a simaizmok helyi összehúzódásához és a vazodilatációhoz vezet, ami gyakran hányást és hasmenést okoz.
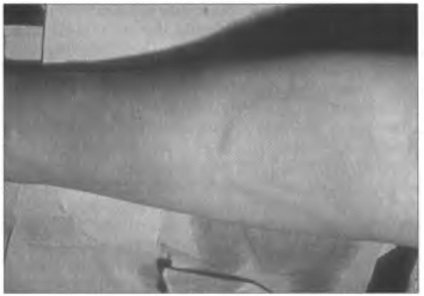
Ábra. 14.7. Bőrreakció hólyagok és hiperémia (atópiás urticaria) formájában
Bizonyos esetekben, a megnövekedett permeabilitása nyálkahártyák allergén felszívódik, és bekerül a véráramba keringő allergén képes indukálni hízósejt-aktiváló a bőrön, ami a megjelenése bőrreakciók formájában hólyagok és részletekben hiperémia, általában az úgynevezett urticaria (atópiás csalánkiütés, ábra. 14,7).
Atópiás dermatitis
Gyermekkorban az allergiás reakció ilyen formája, mint például allergiás dermatitis, leggyakrabban megfigyelhető. Ez a klinikai rendellenesség a citokinek által kiváltott gyulladásos bőrkárosodásnak köszönhető, amelyeket a hízósejtek a degranulálás során felszabadítanak. Ezek az aktív gyulladásos citokinek, amelyek az allergénnel való érintkezés helyének közvetlen közelében szabadulnak fel, serkentik a nagyszámú sejt kemotaxisát gyulladásos zónákba, különösen az eozinofileket. A feltörekvő bőrelváltozásoknál a vörösség és a pustules (fehérvérsejtek) jellemzőek.
Az asztma a helyi anaphylaxis egyik gyakori formája. Ez egy krónikus obstruktív megbetegedése, az alsó légúti, előforduló időszakos súlyosbodása amelyikben a levegő áramlás csökken, és hogy a reverzibilis (legalább részben). Úgy gondolják, hogy az asztma klinikai tünetei a hörgők három fő patofiziológiai változásának eredménye: 1) reverzibilis szűkület; 2) fokozott érzékenység a különböző fizikai és kémiai ingerekre (hiperreaktivitás); 3) gyulladás.
Az utóbbi években az asztma előfordulása az Egyesült Államokban és a betegség súlyossága óriási mértékben nőtt. A legnagyobb halálozás a nagyvárosokban élő gyermekeknél megfigyelhető. Epidemiológiai vizsgálatok azt mutatják, hogy a gyermekeknél az asztmát okozó fő allergén a csótány csípője. Az allergiás asztma sok más allergént is okozhat, pl. Pollen, por, vírusantigének és különböző vegyi anyagok. Ezenkívül az asztma megnyilvánulásait fizikai stressz vagy alacsony hőmérséklet okozhatja, függetlenül az allergén jelenlététől - a belső asztmának nevezett jelenség (Oroszországban, a fertőző gyulladás fogalma, szerk., Ed.).
Úgy gondolják, hogy a légúti gyulladás fontos szerepet játszik ebben a rendellenesség patogenezisében, és a gyógyszeres hatás fő célja az elimináció. Nagyszámú citokinek, különösen az eozinofilok bevonása a gyulladásos zónákban jelentős szövetkárosodáshoz vezet. Ezt a károsodást nagyszámú, a sejtek által felszabaduló mérgező anyagok közvetítik, beleértve a szabad oxigéngyököket, a nitrogén-oxidot és a citokineket. Mindez a nyálkahártya felszabadulását, a fehérjék és folyadék felhalmozódását (ödéma), valamint a hám károsodásához vezet. Együtt, ezek az események a hörgők lumenjének szűkületét okozzák.
A tapadási molekulák kulcsszerepet játszanak a gyulladás korai szakaszában, miután a gyulladásos sejtek részt vesznek. Különböző citokinek által felszabadított TH2 sejtek és hízósejtek (például, IL-4, IL-13 és TNFa), fokozzák az adhéziós molekulák leukociták és endotélium, beleértve az intercelluláris adhéziós molekula 1 (ICAM-1). E szelektin, a vaszkuláris sejtadhéziós molekula 1 (VCAM-1), és működőképesen kapcsolódik leukocita antigén 1-et (LFA-1).
Az eozinofilek az endotéliumhoz való kötődése, melyet egyetlen stimulus indukál, elkezd növekedni, megkönnyítve az eozinofilok migrációját az endothelen keresztül és hosszú távú jelenlétük a tüdőszövetben. Az asztma lehetséges kezelésére megvizsgálták az adhéziós molekulák antagonistáinak (például az ICAM-1 monoklonális ellenanyagainak) alkalmazását. Az ilyen immunterápiás szerek állatokban való alkalmazásának bátorító eredményei növelik az antagonisták kialakulásának érdekét, amelyek biztonságosan alkalmazhatók az emberi kezelésben.
R. Koiko, D.Sanshayn, E.Benjamini