A vírusok termesztésének, jelzésének és azonosításának módszerei
1. Természetes tápanyag (ritkán használt).
A természetes tápközegeket Hanks és Earl sóoldatai alapján állítják elő, amelyekhez szérum, amnion folyadék és embrionális kivonatot adnak. Ezek a biológiai folyadékok fehérje táplálék, vitaminok és más anyagok forrásai, amelyek elősegítik a sejtek növekedését és sokszorozódását. Például a HeLa sejtek tenyésztésére szolgáló táptalaj: humán szérum - 50%, csirkeembrió kivonat - 2%, Hanks oldat - 48%.
2. A fehérje enzimek enzimatikus hidrolizátumai.
Enzim hidrolizátumokat adunk a táptalajhoz: laktalbumin, kazein, szarvasmarha vérfehérje.
3. A komplex összetételben különbözõ szintetikus táptalajok:
Környezet 199 (Parker) 20 aminosavat, 17 vitamint, purint és pirimidint, glükózt, 9 ásványi sót és számos egyéb anyagot tartalmaz. Ezt a táptalajt Hanks-sóoldatban állítjuk elő, amelyet bakteriális szűrőkön történő szűréssel sterilizálunk.
Az Eagle tápanyag 13 aminosavat, 4 kationt, 3 aniont, 6 vitamint, kolint, inozitot és szénhidrátot tartalmaz.
1.2.2. A sejttenyészetek típusai
A sejttenyészetek előállításához különböző állatok, emberek és madarak szöveteit használják, mind embrionális, mind érett. A normális használat mellett a malignus degenerált szöveteket is, amelyek tumorokból származnak.
A forrás embrionális szövetet gyakran csirke-embrió és az emberi embriók, egerek, sertések, nyulak, és mások. Az embrionális és a tumorszövetekben jobb túlélését és növekedését az aktívabb, mint a felnőtt szövetekben. veseszövet leggyakrabban használt érett szövetekben (majmok, tengerimalacok, hörcsögök, stb), a humán amnion membrán.
A szöveteket aszeptikus körülmények között, Hanks-sóoldatban mossák, majd őrlésnek vetik alá. A virológiában csak a növekvő szövetek kultúráját alkalmazzák, amelyek a következőkre oszlanak:
1. Állandó szövetdarabok kultúrája.
2. Egyrétegű sejttenyészetek:
a) primer sejttenyészetek;
b) transzplantálható (stabil) sejttenyészetek;
c) a diploid sejtek kultúrái.
3. A szuszpendált sejtek tenyésztése.
A gyakorlati virológiában gyakoribbak az egyrétegű kultúrák. amelyek sejtjei szaporodnak és szaporodnak, amikor szilárd hordozóra (üveg, műanyag) kapcsolnak, és egy sejt vastagságát (egyrétegű) képezik. Az egysejtes sejttenyészetek feldolgozásának módja az eredeti szövet kezelése az enzimekkel (általában tripszinnel), amely meggátolja az intercelluláris kötéseket; A szövetet diszpergáljuk, és izolált sejtek szuszpenzióját képezzük. Amikor a tenyésztett sejtek kapcsolódnak üvegedény és nő a folyamatos egyrétegű, lehetővé teszi a kényelmes dolgozni a sejteket megfertőző őket vírusok és vizuálisan figyeljük meg a kialakuló változását a dinamika.
a) Az elsődleges sejttenyészetek csak az első generációban képesek reprodukálni
A csirkeembrió fibroblasztok primer tenyészeteinek előállítási eljárása
1. A 7-11 napig inkubált tojásokat mázolják. Az embrió életképességének ellenőrzése után határozza meg a légzsák határait.
2. A tojás homályos végében lévő héjat alkohol, jód, alkohollal töröljük le, majd a légzsák szintjén vágjuk.
3. Távolítsa el az embriót, és helyezze egy steril edénybe, vegye le a fejét. Az embrió testét 3-5 ml Hanks-oldattal mossuk, majd leszívjuk.
4. Az embrió testét alaposan megmunkálták ollóval, az így kapott darabokat (kb. 1 mm3 méretű) pipettázzuk egy kémcsőbe.
5. Végezze el a zúzott szövet 2-3-szoros mosását a vérből. Minden alkalommal öntsön 2-3 ml oldatot egy kémcsőbe egy ronggyal, hagyja, hogy a szövetek leülepedjenek, majd a folyadékot leszívják.
6. Adjunk hozzá 3 ml 0,25% tripszin oldatot a mosott szövethez, és alaposan összekeverjük a cső tartalmát pipettával (többszíves szívás és a folyadék pipetta segítségével történő kifújása) vagy erőteljes rázatással. A tripszin hatására a szövetsejtek szétválasztják és szuszpenziót képeznek, így a nagyobb szövetrészecskék a cső alján ülepednek, a csapadék feletti folyadéknak zavarossá kell válnia.
7. Az izolált sejtek szuszpenzióját tartalmazó felső zavarossági réteg egy centrifugacsőbe kerül, ahol 2,5 ml laktalbumin-hidrolizátum táptalajt előretöltöttünk. Centrifugáljuk 1000 fordulat / perc sebességgel 10-15 percig.
8. A felülúszót eltávolítjuk, 2-3 ml laktalbumin-hidrolizátumot adunk a sejtpelletethez és alaposan összekeverjük, hogy a sejteket ismét szuszpendáljuk. A szuszpenzióba belépő sejtek konglomerátumainak szétválasztása után rozsdamentes acélhálóval vagy gézzel végzett szűrés javasolt.
9. A Goriaev-kamrában a sejtek számlálását a mikroszkóp kicsiny nagyítása mellett végezzük. Miután meghatározta a sejtek koncentrációját a szuszpenzióban, a laktalbumin hidrolizátumát 400 000 sejtre 1 ml-ben hígítottuk.
10. A szuszpenziót 1 ml-es csövekre öntjük, gumi dugóval lefedve, 37 ° C hőmérsékletű termosztátba, ferde helyzetben 50 ° -os szögben.
3-4 nap után a a tenyésztés kezdetén, nézi a csövek kis nagyítással a mikroszkóp, láthatjuk a hosszúkás, folyamat sejtek - fibroblasztok, amelyek nőnek a falon a cső alkotnak egy egyrétegű.
b) transzplantálható sejttenyészetek (sejtvonalak)
A transzplantált sejtkultúrák számos előnnyel rendelkeznek az elsődleges sejteknél. A velük való munka kevésbé időigényes, sok vírus érzékenységében különböznek egymástól. Azonban az átültetett tenyészetek nem alkalmasak vírusos vakcinák előállítására, mivel aggodalmukat fejezi ki a lehetséges malignitásuk miatt.
Az átültetett sejttenyészetek friss táptalajon történő újratermelés nélkül gyorsan degenerálódnak. Ezért az eredeti sejtkultúrát tápláló közeggel rendelkező matracokban tenyésztik, hetente újbóli beültetésre a tenyészetet új edényekben. A vizsgálati kultúrákkal végzett munka során 7-8 napon vagy 3-4 naponként újra kell vetni őket a friss tápközeg pótlására, majd a sejttenyészetek 2-3 hétig megtartják életképességüket.
Termesztésére folyamatos sejttenyészetek felhasznált Medium 199 (gyakran kiegészítve 10% szarvasmarha szérummal), Eagle-féle táptalaj, kiegészítve 20% szérumot, 0,5% laktalbumin hidrolizátummal, amely 5% borjú szérummal.
c) Diploid sejtek kultúrái
Ezeket félig átültetett növényeknek nevezik, hiszen az ini képes hosszú időn át vándorolni - akár 40-50 szakaszon is képes ellenállni 8-10 hónap alatt. Ezután a sejtkultúra degenerálódik és elpusztul. Diploidnak nevezik őket, mert tartósan megőrzik a diploid kariotípust, amely a szervezet eredeti normális sejtjeiben rejlik - a diploid vonal ősei.
A diploid sejtek kultúráját az emberi embrió különböző szövetekből nyerik, az elsődleges tenyészetektől. Így például az emberi embrionális tüdőszövetből származó DCHCH (diploid tüdősejtek), WJT-38, JMR-90, MRC-5 törzsek törzse ismert.
A diploid tenyészeteket vírusok izolálására és termesztésére használják. Számos vírus törzsre érzékenyek, onkogén módon biztonságosak, ipari méretű termesztésre és tömeges mennyiségű vírus vakcinák előállítására alkalmasak.
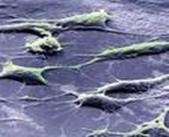
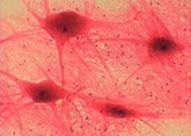
Ábra. 2. Sejtkultúrák
A szuszpendált sejtek kultúrái
A szuszpendált tenyészet olyan kultúra, amelyben az egyes sejteket vagy konglomerátumjaikat folyamatosan felfüggeszti folyékony közegben.
A sejteket szuszpenziós tenyészetben is lehetséges, ha az általuk végzett tenyésztést állandó erőteljes keverés közben forgása által a közeg a csövekben dob egy mágneses keverővel, stb Legutóbb, speciális eszközök - .. kemosztátok amelyben biztosítva van egy automatikus frissítése a közeg. A felfüggesztett sejtek nagyobb növekedési aktivitást mutatnak, nagy mennyiségben halmozódnak fel, és a táptalaj rendszeres cseréje sokáig életképes marad.
1.3. A csirke embriók kifejlesztésében a vírusok termesztése
Számos vírus, amely megfertőzi az embert és az állatokat, többé-kevésbé reprodukál egy csirke embrióban. A sűrű héj jelenléte védi az embriót a mikroorganizmusok külső környezettől való bejutásától.
A csirkeembriókban a vírusok termesztésének módját vírusfertőzések laboratóriumi diagnózisában, valamint vírus vakcinák és diagnosztikus gyógyszerek előállításához alkalmazzák. De ennek a módszernek hátrányai vannak: 1) az embrióban előforduló kóros elváltozások mögötti dinamikában nem lehet megfigyelni a vírusfertőzés után; 2) a nyílás az embrió fertőző vírus gyakran nem kimutatható látható változáson, és ez ahhoz szükséges, hogy a jelenléte a vírus szövetekben egy embrió folyadékokban alkalmazott egyéb virológiai módszerekkel (például, hemagglutinációs reakciót); 3) a csirkeembriók termesztési módja nem alkalmas minden vírusra. A hiányosságok ellenére a módszer viszonylag egyszerű, kényelmes és olcsó, és széles körben használják a virológiai kutatásokban. A legnagyobb érték orthomixovírusokkal, herpeszvírusokkal, poxvirusokkal végzett munkájakor.
1.3.1. A csirkeembrió szerkezete
A csirkeembrió mészkőhéjjal van burkolva - egy héj, amelyre belsejében héjhéj támad. A tojás tompa végében lebomlik, és egy légteret zárt be. Under skorlupnoy héj chorioallantois membrán a tompa végén a tojás akkor végighalad a belsejében a héj skorlupnoy, záró légtér, ez a héj gazdag vérerekben, és arra szolgál, embrió test légzés. Belülről illik allantoisüregébe, amely a szerv elosztása és védi az embriót a kiszáradástól és a kár. Allantoisüregébe körülveszi az embrió, amely a magzatvíz üreg, amely tele van magzatvíz. A tojássárgán keresztül az embrió a tojássárgához kapcsolódik - a tápanyagok fő forrása.
bizonyos hőmérsékleti körülmények között szükséges a sikeres termesztés vírusok a szervezetben a fejlődő csirke embrió (360-380), a páratartalom (50-70%), valamint a megfelelő szellőzés. Egy bizonyos életkorú csirke embriókat 6 és 13 nap között inkubálnak a vírusok típusától és a fertőzés módjától függően. Meg kell készíteni: Palm tojás buborékok egy alkohollal és a jód, a fiolát steril paraffin, terjed poharak, táskák steril géz és gyapjú, papírba csomagolt steril tartályban steril fecskendők, csipeszek, boncolótűvel. Instruments tettünk egy főzőpohárba egy alkohollal, ha azok működését az egész, mielőtt minden további manipuláció sterilizáljuk égő őket egy lángja. A munka előtt alaposan meg kell mosni a kezét, ajánlatos a géz maszkját viselni.
A munkákhoz életképes embriókat választanak ki, és az ovosko-kóban az inkubált tojásokat sugározzák. Az életképes embrió mozgékony, a héj véredényei tele vannak vérrel. Válogatott tojást alaposan fertőtleníteni a tompa végére (vagy az oldalán a tojás) shell törölni alkohollal, jóddal kent többször égetett és egy alkohollal kezeljük.
1.3.2. Chick embrió fertőzése egy chorionallantois membránnal
A 10-12 napos csirke embriókat fertőzésre használják. A fertőzés főbb szakaszai:
1. Egy tojás került egy állványon álló helyzetben úgy, hogy a légzsák felett található, sterilizálás végezzük héj a nagy végén a tojás.
2. A légzsák középpontjától távolítsa el a héjat egy boncoló tűvel.
3. Az így létrejövő lyukba egy ollót állítunk be, és egy belső ablakot kb. 1,5 cm átmérőjű vágunk.
4. A lyukon óvatosan kösse le a héjhéj belső lapját egy tűvel és húzza le egy kis területen (0,5-1 cm2).
5. Produce fertőzött chorioallantois hártyák azt alkalmazni 0,1-0,2 ml vírus-tartalmú anyag egy Pasteur pipettával vagy fecskendővel.
6. Az inzulinblokk egy speciális rugalmas fóliával vagy steril borítólemezzel van lezárva és megolvadt paraffinnal rögzítve.
A fertőzött embriókat függőleges helyzetben termosztátba helyezzük és 2-3 napig inkubáljuk, majd a boncolást az alábbi szabályok szerint végezzük:
1. A tojást az állványra helyezzük úgy, hogy a légtér a csúcson legyen, a nyílás helyének sterilizálása történik.
2. A steril olló a héjat a légtér határa mentén vágja le.
3. Egy csipesz segítségével távolítsa el a héjhéjat a határ mentén. A kitett chorionallantois membránt a héja szélén vágjuk. A kialakított lyukon keresztül a tojás összes tartalmát a csészébe vagy tálcába öntjük.
4. A héj belsejében lévő maradék krómozott héjat alaposan kivesszük csipeszekkel, és steril edénybe helyezzük sóoldattal. Itt kiegyenesítik, és tanulmányozzák a változásokat, és a csészét sötét háttérre helyezzük.
A nagy mennyiség miatt ez az anyag több oldalra kerül:
1 2 3