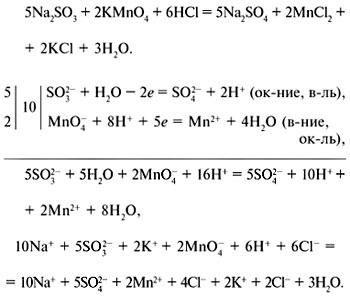Benefit-tutor a kémia területén
10. LEHETŐSÉG 10. évfolyam (első tanév)
Oxidációs redukciós reakciók Terv
1. Oxidációs redukciós reakciók (OVR), oxidációs állapot.
2. Az oxidáció folyamata, a legfontosabb redukálószerek.
3. A visszanyerés folyamata, a legfontosabb oxidánsok.
4. Oxidációcsökkentő dualitás.
5. Az OVR fő típusa (intermolekuláris, intramolekuláris, disproporcionális).
7. Az EIA-egyenletek összeállításának módszerei (elektron- és elektronion-mérleg).
Valamennyi kémiai reakció az atomok oxidációjának mértékében bekövetkező változás alapján kétféleképpen osztható meg: az OVP (amely az oxidációs fokok változásával jár), és nem az OVP.
Az oxidáció mértéke molekula egy atom feltételes töltése, számítva annak feltételezésére, hogy csak a molekulában ionos kötések léteznek.
P ravlya l dla o d p e d e n d e n d s e d s
Az egyszerű anyagok atomok oxidációjának mértéke nulla.
Az atomok oxidációs fokának összege komplex anyagban (molekulában) nulla.
Az alkálifém atomok oxidációjának mértéke +1.
Az alkáliföldfémek oxidációs foka +2.
A bór és az alumínium atomok oxidációs foka +3.
A +1 hidrogénatomok oxidációjának mértéke (az alkálifém és az alkáliföldfémek hidridjeiben -1).
Az oxigénatomok oxidációjának mértéke -2 (peroxidok -1).
Bármely OBR az elektron visszahúzódásának és összekapcsolódásának folyamata.
Az elektron visszahúzódásának folyamata oxidációnak nevezik. Az elektronokat kibocsátó részecskéket (atomokat, molekulákat vagy ionokat) redukálószereknek nevezik. Az oxidáció következtében a redukálószer oxidációs állapota növekszik. A redukálószerek kisebb vagy közepes oxidációs állapotú részecskék lehetnek. A legfontosabb redukálószerek a következők: egyszerű fémek, különösen aktív anyagok formájában; C, CO, NH3. PH3. CH4. SiH4. H2S és szulfidok, hidrogénhalogenidek és fémhalogenidek, fémhidridek, fém-nitridek és foszfidek.
Az elektronok összekapcsolásának folyamatát visszanyerésnek nevezzük. Az elektronokat fogadó részecskéket oxidánsnak nevezik. A redukció következtében az oxidálószer oxidációs állapota csökken. Az oxidálószerek részecskék lehetnek a magasabb vagy közbülső oxidációs állapotokban. Major oxidánsok nemfémek egyszerű anyag, amelynek nagy elektronegativitása (F2 Cl2 O2 ..), kálium-permanganát, kromátok és dikromátok, nitrátok és a salétromsav, tömény kénsav, perklórsav és a perklorát.
A közbülső oxidációs állapotban lévő részecskéket tartalmazó anyagok mind oxidálószerként, mind redukálószerekként, azaz például E. oxidációs-redukciós dualitást mutatnak. Ezek kénsav és szulfitok, hipoklórsav és hipokloritok, peroxidok stb.
Háromféle oxidációs redukciós reakció létezik.
Az intermolekuláris OVR oxidálószert és redukálószert különböző anyagok közé sorolják, például:
Az intramolekuláris OVR - oxidálószer és redukálószer egy anyagba kerül. Különböző elemek lehetnek, például:
vagy egy kémiai elem különböző oxidációs fokokban, például:
Az egyenlőtlenség (önoxidáció-öncsökkentés) - oxidálószer és redukálószer egy és ugyanazon elem, amely köztes oxidációs állapotban van, például:
Az OVR nagy jelentőséggel bír, mivel a természetben előforduló legtöbb reakció ilyen jellegű (a fotoszintézis folyamata, az égés). Ezenkívül az OVR-t aktívan használják az ember gyakorlati tevékenységeiben (fém visszanyerés, ammónia szintézis):
Az EIA egyenletek összeállításához használhatja az elektronikus mérleg módszert (elektronikus áramkörök) vagy az elektron-ion mérési módszert.
Elektronikus mérleg módszer:
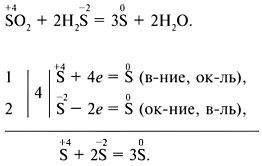
Elektron-ion mérési módszer: