Króm-oxidok kémiai katalógusa
OXIDOK CHROME
OXIDOK CHROME. A Cr-O rendszerben (ábra) léteznek CrO, CrO2 oxidjai. Cr2O3, stb. CHROME OXIDES o. összehasonlítjuk a táblázatban. Alsó-oxid CrO metastabil pont összetételét annak a Cr-Cr2 O3 rendszer ítélik olvadni laminálás, amely kiterjeszti 2-48 at.% O. Ez a rendszer is megtalálható inkongruens olvadási oxid Cr3 O4. amelyek a fenti hőmérsékleteken vannak jelen
1550 ° C. A torzított spinell szerkezete van.
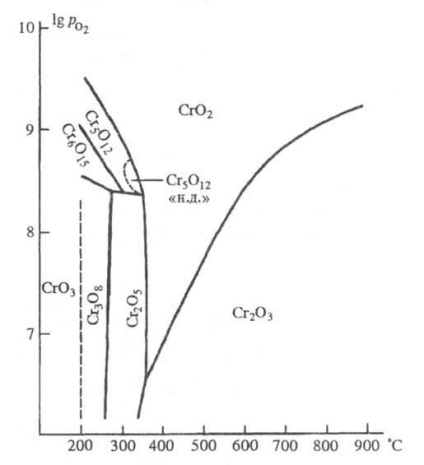
Króm-oxidok stabilitása: - Oxigénnyomás (Pa); "ND" - alacsony nyomású.
CrO - vörös kristályok vagy fekete piroforos por; kristályos. A CrO a levegőben stabil, vízben oldhatatlan, de intenzíven oxidálódik
100 ° C Reagál a HCl-val a hidrogén evolúciójával, hígított HNO3 és H2S04 nem kölcsönhatásba lép. A CrO-t úgy kapjuk meg, hogy a karbonil-Cr (CO) 6 termodinamikusan bomlik. Az O2-ből származó szénhidrogéneket tisztító adszorbensként használják.
Cr (OH) 2-hidroxid barna vagy sárga csapadék válik le a Cr (II) sók oldatából lúgokkal oxigén nélkül; 2,0 x 10 -20 oldhatósági termék; nem oldódik lúgos oldatokban és híg savakban, lassan oldódik a konc. savak; gyorsan levegőben oxidálódik.
Cr (III) -oxid (sesquioxid) Cr2O3 (ásványi escoilit) korund típusú szerkezettel rendelkezik. A színe világos zöld színű, finoman eloszlatott anyagban nagy kristályoknál majdnem fekete. Fűtött állapotban a zöld szín barna színűvé válik. Vannak amorf Cr2O3. és spinel típusú szerkezetű (a = 0,836 nm) barna színű, metastabil, kubikus forma. A tetragont is leírták. (a = 0,9480 nm, c = 0,5160 nm), láthatóan stabilan 1000 ° C fölött. Cr2O3 jelentős mértékben illékony
1200 ° C; egyenletesen elpárolog, gőzök disszociációjával; az lgp (mm Hg) = 10,62 - 25300 / T (1504 - 1821 K) gőznyomás hőmérséklet függvényének egyenlete; paramágneses, 32 K-os (a Neel-pont) antiferromágnesbe kerül. állapot, 0,80 kJ / mol átmenet; félvezető, sávszélesség
3,4 eV; keménység a Mohs skálán 9.
A CHROME-OXIDOK TULAJDONSÁGAI
* Incongruent. ** forráspont 3000 o C.
A Cr2O3 kémiailag inaktív. Nem oldódik vízben és szerves oldószerekben, nincs kölcsönhatás a lúgok oldatával, oldhatóság. erős savaknál csak hosszan tartó fűtéssel oxidálódik és oldódik a perszulfátok vagy klorátok forró oldatainak hatása alatt, valamint 70% HClO4. KNO3 és KClO3 olvad. az alkáli kölcsönhatás a levegőben történik. Fémoxidokkal vagy karbonátokkal történő szintereléskor kromitokat képez (Lame). Kölcsönhatást. karbonát jelenlétében, klór jelenlétében 650-850 ° C-on. magasabb
1500 ° C a H2 hatására a fémre redukálódik. C, CO, Si, Al, Ca, Mg és hasonlók.
A Cr2O3-ot hidroxid vagy hidratált kromokromát termodinamikai bontásával (lásd alább), CrO3-ot kapjuk. (NH4) 2Cr2O7. a Na vagy a K dikromátokat szénnel kalcináljuk, majd a Cr oldódást O2-ban égetjük. A nagyfrekvenciás oxidot szerves klórvegyület, például etil-benzol-kromium oxidálják. Cr 2 O 3 alkalmazása fémes előállítására. és a króm-karbidok, mint egy pigment, a szerves szintézis katalizátort (oxidációs, repedés, hidrogénezést és dehidrogénezést), mint a fényesítő anyag, tűzálló alkotórész ferritek.
Számos Cr (III) hidroxid ismert. Amikor az intézkedés a sók vizes oldatai a Cr (III) által képezett alkálifém- vagy ammónium-hidroxid-gél csapadék keletkezik Cr (OH) 3 x NH2 O. hidroxiddal vízben oldhatósága július 01-10 tömeg% 25 ° C-on Színét (kék, zöld, zöldes-fekete vagy ibolya), valamint a kémiai aktivitást a lerakódás körülményeitől teszi függővé. A hidroxid ásványi savakban és alkáli oldatokban könnyen oldható. A csapadékvesztés korában csökken a reakcióképességük. A csapadék megszárításakor keletkezik a Cr (OH) 3 x 3H20 hidrát, amelyet kristályos formában kaphatunk. formában; szerkezeti hatszög. (a = 1,230 nm, c = 0,970 nm, z = 8, egyéb adatok, a = 0,531 nm, c = 0,487 nm); sűrűsége 1,64 g / cm 3. Alacsony stabilitású, tárolás közben, és ha felmelegszik
A 70 ° C amorf hidrátra, Сr2O3 x 5N2 О, egyenletesen emelkedik
85 ° C. További dehidratálással Cr (OH) 3 amorf hidroxidot kapunk. Kristályosodik az Al (OH) 3 bayerit szerkezetben. rácsos hatszög. (a = 0,5288 nm, c = 0,4871 nm, z = 2), sűrűsége 2,90 g / cm3; 150 ° C-on dehidratáljuk. A hidroxid a Cr (III), katalizátorok, ferritek sói előállítására szolgál.
Ismert továbbá a Cr2O3 x nH2O összetételű hidrát - smaragdzöld, vagy Giye zöldjei, ahol n értéke 1,5-2; nem oldódik ásványi savakban, alkáli oldatokban, könnyen oldódik a CrO3 oldatokban. Ellenáll a levegőnek. Ha felmelegszik
200 ° C-on elveszti a legtöbb vizet (H2 O 0.5), de amikor ki vannak téve a levegő ismét elnyeli azt. Teljesen dehidratált körülbelül 600 ° C-on. Úgy állítjuk elő, kalcináljuk keverékét K2 Cr2 O7 H3 BO3 500-600 ° C hőmérsékleten, majd mosódik Cr-hidroxid által autoklávban azzal a kiegészítéssel, bórsav vagy kovasav, vagy redukciójával Na2 Cr2 O7 szerves-te (például melasz) egy autoklávban. Alkalmazzunk pigmentként.
SrOON -oxihidroxid (vagy Cr2 O3 x H2 O) ismert, mint egy többszörös modifikatsiy.Modifikatsiya (Grimaldi ásványi) kristályokat képez, kékes-szürke, kékes-zöld vagy barna-vörös színű; van rombusz. szerkezete (a = 0,2960 nm, c = 1.329 nm, Z = 3, a tér-csoport ;. sűrűsége 4,12 g / sm.Modifikatsiya zöld (gvianait ásványi) van rombich rács (a = 0,4861 nm, b. = 0,4292 nm és c = 0,2960 nm, Z = 2, terek csoport EPTA); sűrűség 4,57 g / cm 3. A harmadik módosítás (bresuellit ásványi) vörös-barna színű van rombich diaszpor típusú szerkezet (a. = 0,449 nm, b = 0,986 nm, c = 0,297 nm, Z = 4, tércsoport Rbpt). ismertetett smaragdzöld-módosítást is rombos, a szerkezet a böhmit típusú (terek. csoport Cmcm). vannak arra utaló jelek, hogy léteznek más egy, köbös, m szürke-ibolyaszínű színezés.
Az oxohidroxid a levegőben stabil, gyakorlatilag nem reagál ásványi savakkal és alkáli oldatokkal. A fűtés során fellépő viselkedés különbözik a különböző módosításoknál. A kiszáradás 370-440 ° C-on, 480-550 ° C-on végzett módosítás, 520-570 ° C-on végzett módosítások. A SUN a Cr (III) hidroxid részleges dehidratálásával jön létre. Split. termék Cr2O3 előállítása során.
A CrO2-dioxid egy rutil típusú szerkezetben kristályosodik; egyes adatok szerint homogén tartomány (O: Cr 1,901 - 2,013 arány); ferromágnes, fémes. vezetőképesség; 110 ° C-on paramagnál vezet. állapot (a szerkezet megváltoztatása nélkül). a
510 ° C-on Cr2O3-ra bomlik. A levegőben stabil, hosszú ideig forralva vízben aránytalan a CrOH és a H2 CrO4 esetében. Sósav hatására oxidálódik a Cl2 felszabadításával. A CrO3 vagy Cr5O12 vagy Cr3O8 CrO2 bomlása hidrotermális körülmények között; a magnéziumhordozók munkaanyaga. felvételt.
Ismeretes egy amorf paramagnum. a CrO2 formája barna vagy fekete. Víz nyomokat tartalmaz, és általában enyhén kevesebb oxigént tartalmaz; annak képletét néha Cr5 O9 x aq. Ha teljesen dehidratálódik, bomlik. A dioxid hidrátjaként figyelembe vehető a [Cr (OH) 2] 2Cr04-hidroxikromát. amely Cr (III) és Cr (VI) tartalmú oldatokból származik, pH 3-4 értéken; egy barna röntgen-amorf anyag, amely további 5-5,5 vízmolekulát tartalmaz; egy fél termék bizonyos vegyületek előállítása során Cr.
Leírunk gidroksohromaty Cr (III) - a Cr (OH) 2 (NSrO4) x 4H2O (állva az anyalúgot átalakul x SrO2 2H2 O) SR5 (OH) 9 (SrO4) 3 x PN2 O. Mindezek amorf , híg ásványi savakban és lúgos oldatokban könnyen oldódik, melegítéskor, dehidratálva és
250 ° C-on bomlik. Az xCr2O3 x yCrO3 x nH2O általános képletű króm (III) hidroxikromatátokat gyakran krómozott kromátoknak nevezik.
Megmutatták a Cr 4 O 7 és a Cr 6 O 11 oxidjainak létezését.
Oxide Cr5 O12 kromát (VI) króm (III). Nyilvánvalóan, egy fázis változó összetételű, amelynek homogenitását régióban fekszik a tartományban kompozíciók SrO2,4 - SrO2,48 (szerinti egyéb adatok SrO2,385 a CrO2,430.). Finom fekete tűk. Nem oldódik vízben, híg ásványi savakban oldódik; oxid, amely nagy nyomáson keletkezik, bomlik a konc. H2SO4-ot reflux alatt. A táblázatban szereplő adatok. a strukturális paraméterek nem ferromágnesesre utalnak. nagy nyomás módosítása. A ferromágnes szerkezete. (sűrűsége 3,29 g / cm3) nem vizsgálták.
A Cr2O5 két oxidációs állapotban krómot is tartalmaz, szerkezeti képlete Cr2 (CrO4) 2 (Cr2O7). Leírjuk két módosítással - monoklin a antiferromágneses Neel hőmérséklet alatt 80 K és nagy nyomáson a meglévő rombusz, amelyre képletű SR6 O15 javasolt. Ezek fekete lamellás kristályok. Ne reagáljon vízzel és híg savakkal, amelyek oldódnak a konc. H2S04 szobahőmérsékleten. A CrO3 vagy Cr3O8 termodinamikai bomlása O2-atmoszférában (270-300 ° C).
A Cr2O5 hidrátjaként megfontolandó, hogy a hidroxid kromát Cr (OH) Cr2O7 x2H2O vizes oldatokból kicsapódik. Barna, amorf anyag, amely híg savakban és lúgokban oldódik; 100-160 ° C-on dehidratáljuk, 250-350 ° C-on bomlik.
Cr3O8 [vagy Cr2 (Cr2O7) 2 (Cr3O10) oxid nagyon finom sötétbarna kristályok; antiferromagnet, Néel hőmérséklet
Kémiai enciklopédia. 5. kötet >> A cikkek listájához