Kloroplaszt pigmentek - biológia
4 kloroplaszt pigmentek
A pigmentek a fotoszintetikus készülék legfontosabb elemei. A növényi pigmentek vizsgálata az MS Tsveta orosz növényi fiziológus munkája miatt gyors ütemben gyorsult. Megpróbálják megtalálni a módját, hogy a pigmenteket különálló anyagokra szedje, Color 1901 - 1903. Felfedezte az alapvetően új módszert, amelyet adszorpciós kromatográfiának nevezett. Az oldószer oldószerrel való oldószerét egy abszorbenssel átvezetjük az oszlopon. Mivel az anyagok az adszorpció mértékében különböznek egymástól, az oszlopon különböző sebességgel mozognak. Ennek eredményeképpen az anyagok elkülönülnek. Ezt a technikát széles körben használják a modern biokémiai, kémiai és néhány iparágban. A kromatográfiás módszer alkalmazásával a szín két klorofill-t és a b-t detektált, és a lemez sárga pigmentjeit három frakcióra különítették el.
A pigment plastidok három csoportba sorolhatók: klorofill, phycobilin és karotinoidok.
4.1 Klorofillok: összetétel, szerkezet, bioszintézis, optikai és kémiai tulajdonságok, érték
Ez az első alkalom a klorofill kristályos formában írtuk le orosz fiziológus és botanikus IP Borodin 1883 Később kiderült, hogy ez nem a klorofill, és néhány módosított formában - ethylchlorophyllide.
A lengyel biokémikusok, M. Nentsky és L. Marchlevsky (1897) szerint a klorofillmolekula alapja, mint a hemoglobin hemoglobin, a porfiringyűrű. Így bizonyították ezeknek a pigmenteknek az alapvető szerkezeti hasonlóságát növényekben és állatokban.
Német kémikus R. Willstatter 1906-1914-ben. Megalapította az elemi összetétele a klorofill-a - C55H72O5N4Mg és klorofill b - C55H70O6N4Mg, német biokémikus G. Fischer 1930-1940. teljes mértékben megfejtette a klorofill szerkezeti képletét. 1960-ban az RB szerves kémikusok. Woodward (USA) és M. Strell (Németország) mesterségesen szintetizálták a klorofillt. A klorofill - dikarbonsav-észter-klorofillin, amelyben egy karboxilcsoportot észterezünk, maradékot metil-alkoholban, és más egyértékű telítetlen alkoholt maradékot fitol. A klorofill a szerkezeti képlete az ábrán látható:
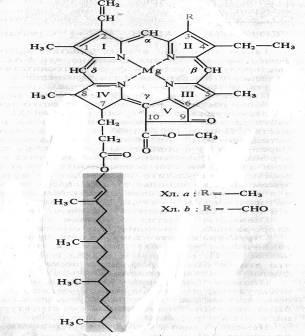
A négy pirrol gyűrűt (I-IV) összekötjük metánhidakkal, porfirin magot képezve. A tetra-pirrol gyűrűben lévő külső szénatomokat 1-10-ig jelöljük. A pirrol gyűrűk nitrogénatomjait négy koordinációs kötéssel kölcsönhatjuk a magnézium atomjához. A szerkezet a porfirin mag is egy ciklopentán gyűrűt (V), maradék képződik ketopropionovoy savat tartalmazó reaktív karbonilcsoportot C9 és metilezett karboxilcsoportot C10. A tetrapirrol és ciklopentán gyűrűkből álló struktúrát forbinnak neveztük el. Az oldallánc IV pirrolgyűrű magában propionsav kapcsolódik egy észterkötésen keresztül kötést egy alkohollal fitollal telítetlen poliizoprén (S20N39ON). A pirrol gyűrűk 1., 3., 5. és 8. szénatomja metilcsoport, a második vinilcsoport, a negyedik etilcsoport. A porfiringyűrű kilenc pár konjugált (konjugált) váltakozó kettős és egy kötésű rendszer, melynek 18 delokalizált p-elektronja van. A b klorofill különbözik a klorofilltói, hogy metilcsoport helyett 3-szénatomos formilcsoport (-CHO) csoport. A klorofill szerkezetet, a fitol nélkül, klorofillidnak nevezik. Amikor a magnéziumot a klorofillmolekulában lévő protonokkal helyettesítik, a megfelelő pheopetin képződik.
Az a, b, c, d klorofillokat magasabb növényekben és algákban találtuk. Valamennyi fotoszintetikus növény, beleértve az összes alga-csoportot, valamint a cianobaktériumokat, tartalmaz az a csoport klorofilljait. A klorofill b magasabb növényekben, zöld algákban és euglénában található. Barna és diatómális algák esetében a klorofill b helyett klorofill van jelen, és a klorofill d számos vörös algában. A fotoszenzitást végző fotoszintetikus baktériumokban különböző bakterio-klorofillok találhatók.
A klorofillok bioszintézise. Az első lépés a bioszintézis klorofill a növényekben - a kialakulását 5-amino-levulinsav (K A L) C5-dikarbonsavak. Az eredmények azt mutatják, hogy a glutaminsav a 2-gidroksiglutarovuyu alakítjuk 4,5-dioksovalerianovuyu, amelyet azután amináljuk rovására egy alanin vagy más aminosavakkal (ábra. 5.2). A transzaminálási reakciót katalizálja az ALA-transzamináz, amely a piridoxál-foszfátot koenzimként tartalmazza. Az ALA szintéziséhez az ozmoglutár (2-oxoglutársav) is alkalmazható. Az ALA két molekulájának ciklizálása egy pirrolvegyület - porfobilinogén képződéséhez vezet. A négy pirrol gyűrű közül uroporphyrinogént alakítunk ki, amelyet protoporfirin IX-é alakítunk át. A protoporfirin transzformációinak további módjai eltérőek lehetnek. A vas formált hem, amely része a citokrómnak, a kataláznak, a peroxidáznak és a hemoglobinnak. Ha protoporfirin molekulát aktivált magnézium, majd a karboxilcsoportot észterezzük a C10 metil-6-b-adenozil-metionin, és bezárja ciklopentán-gyűrű (K) van kialakítva protoklorofillid. Hatása alatt a fény egy pár másodpercig, hogy klorofillid protoklorofillid transzformált eredményeként hidrogénezésével a kettős kötés C7 - C8 IV a pirrol mag. Az alsó növényeknél és néhány gymnospermében (tűlevelűeknél) a klorofillid a sötétben alakulhat ki. A klorofillid ugyanazokkal a spektrális tulajdonságokkal rendelkezik, mint a klorofill. Az utolsó lépés a kialakulását a klorofill molekula és - fitol észterezés, amely, mint az összes poliizoprén a vegyületet acetil-Koa keresztül mevalonsav. Az AA Shlyk (1965) szerint a klorofill b alakulhat ki az újonnan szintetizált klorofill-a molekulákból. Minden leírt eljárást, amely az ALA kialakulásával kezdődik, kloroplasztokban végezzük. Az első jelei tétele, nőtt a sötétben elhervadt zárvatermőkhöz után megfigyelhető 2-4 óra után a világítás.
A klorofillok fizikai-kémiai tulajdonságai.
A szilárd formában a klorofill a kék-fekete szín amorf anyaga. Az klorofill a olvadáspontja 117-120 ° C. Klorofillokat nagymértékben oldódik etil-éterben, benzolban, kloroformban, acetonban, etanolban, mérsékelten petrol-éterben oldódó, és vízben oldhatatlan. Az etiléter-klorofill-oldat kék-zöld színű, klorofill b sárga-zöld színű. A klorofillok élesen kifejezett abszorpciós maxima a spektrum vörös és kék részein helyezkedik el.
Az etil-éter abszorpciós maximumok a klorofill-a csoportot a piros részét a spektrum - a tartomány 660-663 nm, a kék - 428-430 nm, a klorofill b -, illetve belül 642-644 és 452-455 nm-nél. A klorofillák nagyon gyengén elnyelik a narancssárga és a sárga fényt, és egyáltalán nem szívják fel a zöld és az infravörös sugárzást. A spektrum kék-ibolya részében a felszívódás a klorofillmolekula porfirin gyűrűjének konjugált egy és kettős kötéseinek rendszeréből adódik. Intenzív abszorpciós sáv a vörös tartományban társított hidrogénezése a kettős kötés C7 - C8 IV a pirrol mag (ha lesz egy protoklorofillid klorofillid) és magnézium jelenlétében a porfirin-gyűrű. Ugyanezek a feltételek hozzájárulnak a spektrum sárga és zöld részeinek abszorpciójának csökkenéséhez. Helyettesítés magnézium protonok savas kezeléssel képződését eredményezi klorofill feofetina amelynek barna-zöld és vörös abszorpciós maximum legyengített. A fitol és a metil-alkohol lúgos hidrolízissel való eltávolítása kevés hatással van a klorofill abszorpciós spektrumára. A klorofillin ugyanazokkal a spektrális tulajdonságokkal rendelkezik, mint a klorofill: zöld, piros és kék abszorpciós maxima.
A helyzet a maximumok az abszorpciós spektrumot jellege befolyásolja az oldószer és a kapott klorofill molekulák egymással és más pigmentek, lipidek, és a fehérjék. A aggregált klorofill molekulák (például, szilárd filmeket és a klorofill jelen kloroplasztisz) vörös abszorpciós maximum eltolódik a hosszabb hullámhosszak (680 nm).
A poláros oldószerekben lévő klorofillok oldata világos fluoreszcenciával rendelkezik (lumineszcencia). Az etil-éter a klorofill és van egy rubin-vörös fluoreszcencia amelynek a maximuma 668 nm-nél, a klorofill b - .. 648 nm, azaz, a fluoreszcencia maximumok szabálynak megfelelően több Stokes eltolódott a hosszabb hullámhosszak a spektrum tekintetében a abszorpciós maximuma. Az összesített klorofill és a klorofill natív állapotban (élő levélben) kissé fluoreszkál. A klorofillok oldata szintén képes foszforeszkálásra (azaz hosszú utóégetésre), amelynek maximális értéke az infravörös tartományban van.
A fluoreszcencia és a foszforeszcencia mechanizmusai, beleértve a klorofillmolekulákat, meglehetősen jól vizsgálták. Azok legstabilabb államok az atomok és molekulák, amelyekben vegyérték elektronok elfoglalják a legalacsonyabb energiaszint és eloszlásban szerinti a Pauli-elv (maximum két elektron ellentétes forog minden orbitális). A molekula ezen állapotát az alapvető szingulett (S0) energiaállapotnak nevezzük. Ebben az esetben a molekula összes elektronjának összes spin (a mágneses momentumok vektora) nulla. Ha egy molekula elnyeli a fénymennyiséget, akkor ennek az energiának a rovására az elektron magasabb üres pályákon halad át. Ha a gerjesztett elektron megtartja ugyanazt a centrifugálási irányt, akkor a molekula a szinglett gerjesztett állapotban van (S *). Ha egy elektron spinja magasabb keringési pályára fordul, akkor ezt a gerjesztést tripletnek nevezik (T *). A földi állapotról a triplet állapotra való közvetlen átmenet valószínűtlen esemény, mivel megköveteli a centrifugálás irányának visszafordítását. Átmenet a molekula a alapállapotú a gerjesztett előforduló abszorpciója után a fénymennyiség megfelel a sáv az abszorpciós spektrumot.
A vörös fény kvantumának egy klorofill molekula általi felszívódása szingulett elektron-gerjesztett állapotot eredményez - S * 1.
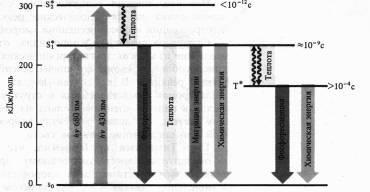
Ha egy magasabb energiaszintű kék fény kvantum felszívódik, akkor az elektron magasabb pályára (S * 2) halad. A klorofill gerjesztett molekula különböző módon tér vissza a talajállapotba. Miután az energia részaránya hőnek köszönhetően (különösen az S * 1-es szinttől), a molekula egy olyan hullámhosszú kvantumot bocsáthat ki, amely hosszabb hullámhosszú (Stokes-szabály), amely fluoreszcencia formájában jelenik meg. Amint már említettük, a klorofill a fény spektrumának vörös és kék tartományában elnyeli a fényt, de csak pirosan fluoreszkál. A szinglett gerjesztett állapot élettartama 10-13-10-9 s.
Az energia elvesztésének másik módja az, hogy a molekulát a szingulett gerjesztett állapotból a metastabil tripletbe (spin megfordítással) átvisszük. Ez az átmenet nem sugárzó, vagyis az energiát hő formájában veszítjük el. A triplett gerjesztett állapot sokkal hosszabb élettartammal rendelkezik (> 10-4 s). A tripletállapotból a molekula visszatérhet a földi állapotba, és még egy hosszabb hullámhosszat (mint a fluoreszcencia esetén) egy fény kvantumát képes kibocsátani. Ez általában gyengébb fény és foszforeszcencia.
Végül a gerjesztett állapot energiája fotokémiai reakciókhoz alkalmazható. Ebben az esetben a klorofill fluoreszcenciáját és foszforeszkálását nem figyeljük meg.
A szerkezet a klorofill molekula, kiválasztott a fejlődése számos más szerves pigmentek, tökéletesen alkalmazkodott annak funkcióit érzékenyítő fotokémiai reakciók. Ez áll a 18 delokalizált π-elektronok (képviselők a szerkezeti képletben a klorofill formájában 18-tagú gyűrűk a konjugált kettős kötések) így klorofill könnyen gerjeszthető molekula felszívódását fénymennyiség.
Több Timiriazev azt javasolta, hogy a klorofill képes redox átalakulás. Először klorofill fotoredukciós reakciót hajtottuk végre, modell kísérleteket A. 1948 g. Krasnovskii klorofill, piridinben oldjuk, anaerob körülmények között, az intézkedés alapján fény csökkenti aszkorbinsavat vagy egyéb elektrondonor. Ez képezi a rekonstruált ( „vörös”) formát egy abszorpciós maximuma klorofill 525 nm-en:
A fény kikapcsolása után a reakció az ellenkező irányba halad. A redukált klorofill viszont visszaállíthatja a különböző elektron-akceptorokat. Ugyanabban a modellrendszerben, de egy elektron-akceptor hozzáadásával a klorofill érzékelõként hat a megvilágítás alatt:
Ilyen körülmények között csökken a NAD +, a riboflavin, a kinon és a Fe3 +. oxigént. Ezeket a reakciókat Krasznovszkij reakcióinak nevezték. Így a klorofill molekula nem csak az elsődleges elektron-akceptor szerepében játszódhat, hanem az elsődleges donor szerepében is.
Ebből következik a fentiekből, hogy a klorofill molekula miatti szerkezeti és fizikai-kémiai jellemzői végezhet három fontos funkciója van: 1) szelektíven elnyelik fényenergiát, 2), hogy tárolja azt a formáját elektronikus gerjesztési energia, 3) a fotokémiai átalakítani az energia a gerjesztett állapot kémiai energiává elsődleges photoreduced és a képi oxidált vegyületek.
A klorofillmolekula működésének a fotoszintézis folyamataiban nagy jelentőségű a térbeli szervezete. A molekula magnézium-porfirin gyűrűje majdnem lapos lemez, vastagsága 0,42 nm, és területe 1 nm2. Ez a klorofill molekula hidrofil része. A porfirin gyűrűvel szöget bezáró hosszú alifás fitolmaradék (2 nm) a hidrofób pólusa. amely szükséges a klorofillmolekula és a membránfehérjék és lipidek hidrofób régióinak kölcsönhatásához.
Információ a munkáról: "Fotoszintézis alapja a bioszféra energiájának"