Kilátások a sejtekben lévő fehérjék cseréjére és címzésére
A helyszínen található cikkek többségének célja, hogy megmagyarázza, hogyan továbbítják a fehérjéket az endoplazmatikus retikulum (EPR) membránján keresztül. Ez főként annak köszönhető, hogy az EPR szállítási funkciót a legjobban tanulmányozták. A szekréciós fehérjék transzlokációjának fő módját részletesen tanulmányozták. Az összetettebb szubsztrátok transzlokációjával kapcsolatos kérdések azonban nem ismertek, különösen a membránfehérjék integrálásában.
Hogy vannak vezetve transzmembrán domént és ami meghatározza azok integrálása a membrán? Mi a szerepét a kölcsönhatás a TM domének, amelyek előtt történik az integráció? Ezzel együtt, világossá válik, hogy transzlokáció egy kiigazítási folyamat, amelyben a pozicionáló hatékonyságát fehérje transzfer és az integráció, valamint a szükséges tényezők nagyban függ a szubsztrát és a feltételeket, amelyek a sejt található. Bár nem értem, hogy a transzlokáció szabályozza, és hogy a sejt végzi a folyamat összhangban a kéréseket.
Bár a transzlokációs csatorna struktúráját tisztázották, a mobilizációs módszer és a transzlokon portálmechanizmusa még vizsgálva van. Hogyan érzékeli a jelszekvencia szerkezeti változásokat a csatornában? A csatorna szerkezete rugalmas-e az áthelyezett lánc átirányítására, vagy több transzmembrán domén felhalmozódásának biztosítására? Mi történik a csatornaszerkezettel a transzlokáció befejezése után? Mikor és mikor kötődnek hozzá a transzlocénhoz közeli fehérjék?
Még kevésbé feltárt, mint EPR végez fehérje feltekeredés, valamint felismeri és eltávolítja a fehérjék szabálytalan szerkezetű. Szinte teljesen vizsgálták a legalapvetőbb szempont a folyamat, hogyan organel la „érzi” a helyes és helytelen összeállított fehérje sok kitalálni, hogyan befolyásolja a chaperon proteinek. Meg kell határozni, hogy milyen szoros kölcsönhatásban számos rendszer EPR gardedámok és van-e más, vagy az egymást átfedő funkciók. Az is világos, hogy egy sejt dönt fehérje lebomlását, amelynek szabálytalan szerkezetű.
Vonzónak tűnik egy olyan mechanizmus létezése, amely korlátozza a kapcsolatokat a chaperonokkal. Azonban nincsenek feltételezések arra vonatkozóan, hogyan működhet. Végül nem ismert, hogy a bomlásra kiválasztott fehérjét hogyan visszük vissza a csatornába és a citoszolba. Ugyanez vonatkozik a mechanizmusra, amellyel egy csatorna belülről nyitható.
Végül a mechanizmusok ismeretlenek. az EPR egészének dinamikáját. Hogyan tartja fenn a jellegzetes formáját az organelle? Hogyan támogatják a részkomponenseket? Hogyan kapcsolódik az EPR a citoszkeletonhoz és hogyan mozog a sejtben? Mi határozza meg az EPR méretét és hogyan bővül? A strukturálatlan fehérjék reakciója az EPR és a mag középpontját mutatja. Lehetséges, hogy egy ilyen kapcsolat jelenléte segítséget nyújt az EPR felsorolt funkcióinak megválaszolásához. Az EPR és más cellás rekeszek között fennálló kapcsolatok jelenléte lehetővé teszi számunkra, hogy feltételezhető, hogy közöttük van lehetőség, bármennyire konkrétan ez megtörténhet, ismeretlen marad.
A sejt számos különböző organellát tartalmaz. körülvéve membránok, amelyek közül néhány importált fehérjéket közvetlenül a citoszolba. Mitokondriumok, kloroplasztiszok és peroxiszómákra importálja a szükséges fehérjéket. Az endoplazmás retikulum (ER) mint a fehérjék importált citoszolba, de a legtöbb ezek közül a fehérjék szállítják tovább, vagy eltitkolt vagy funkciók ah sejtszervecskék és membránok, amelyek nem tudja importálni fehérjéket magukat. Ezek közé tartozik a plazma membrán és az organellumok a szekréciós és endocitikus útvonalon.
A szervezetben behozott fehérjék. a szignálszekvencia azonosítja, amely egy rövid aminosav-lánc, amely rendszerint a lánc N-terminálisán helyezkedik el. A különböző organelláknak megfelelő szekvenciák hossza és összetétele eltér egymástól. Az EPR szekvenciák körülbelül húsz aminosavat tartalmaznak, és hidrofób aminosavakból álló kiterjedt régióval jellemezhetők. A mitokondriumok jelzőszekvenciái hasonló méretűek. Ezek azonban hidrofób és töltött aminosavak váltakozó csoportjait tartalmazzák. Ezért, amikor a jelszekvencia hélix formájú, az egyik oldal hidrofób és a másik oldal hidrofób, a másik pedig hidrofób.
A peroxiszóma szignálszekvencia rendszerint csak három aminosavmaradékból áll. Minden esetben a fehérjék azonosítása és elhelyezése már nem a szignálszekvenciák összetételének megfelelően történik, hanem fizikai tulajdonságaik alapján.
A szignálszekvencia minden típusa kötődik egy specifikus receptorhoz. amely a fehérjét egy bizonyos organelle irányítja. Amikor a fehérje eléri az orgonát, a membráncsatornán keresztül átkerül. A jelszekvencia felismerésének pillanatától, a fehérje szintézisének vagy befejezése után a transzlokáció típusa függ. A kotranszlációs transzlokáció olyan esetekben fordul elő, amikor a szignálszekvenciát felismerik a fehérje szintézis során. Ebben az esetben a riboszóma, amelyre a fehérje szintetizált, kötődik a membránhoz, és a kapott fehérje átkerül a transzlokációs csatornába. A poszttranszlációs transzlokáció akkor következik be, amikor a szignálszekvenciát a proteinszintézis befejezése után ismeri fel.
A legtöbb fehérje a transzkripciós transzlokációba belép az EPR-be. Közvetlenül a jelszekvencia kimenete után a riboszómából egy jelet felismerő részecske (SRP) kapcsolódik hozzá. A riboszóma és a növekvő fehérje az EPR membránon helyezkedik el az SRP és a receptor kölcsönhatása miatt. Ezután a riboszóma a növekvő lánccal együtt elfoglalja azt a csatornát, amelyen keresztül a fehérje áthalad a membránon. A csatorna magját a komplex Sec61 alkotja, körülötte - a transzlokációban résztvevő fehérjék nagy csoportja. Mindezt együttesen transzloconnak nevezik. A jelszekvenciával való kölcsönhatáskor megnyílik a csatorna, amely lehetővé teszi a lánc számára, hogy olyan módon juthasson be, amely kizárja más molekulák EPR membránon keresztüli szállítását. A fordítás folytatódik mindaddig, amíg a riboszóma csatlakozik a csatornához, és a fehérjét átvezetik a lumenbe.
A fehérje integrálása az EPR membránba abban a pillanatban kezdődik, amikor a transzmembrán doménet lefordítják és belépnek a csatornába. Mivel a transzmembrán domének hidrofób jellegűek, a csatornát felismerik, és a falukon átjutnak a membrán lipid kettős rétegébe. A transzmembrán domén felismerése után megszűnik a kapott fehérje membránon keresztüli transzportja. Továbbra is folytatódik a fordítás, ami a polipeptidlánc további szakaszainak kilépéséhez vezet a citoszolba. A membránfehérjéknek több transzmembrán doménhez történő teljes integrálása érdekében valószínűleg szükséges a csatorna több megnyitása és zárása.
A membránfehérjék integrálásának folyamatát bonyolítja a membránban való specifikus orientáció szükségessége. Nyilvánvaló, hogy ez függ a fehérjék transzmembrán doménjeinek tulajdonságaitól. Azonban nem világos, hogy a doméneknek hogyan kell kölcsönhatásba lépniük a csatornával, a membrán lipidekkel vagy egymással, hogy meghatározzák a fehérjék tájékozottságát.
Amikor transzlokáció EPR számos fehérje alávetni kovalens módosítás. Általában egy szignál szekvenciát peptidáz hamarosan eltávolítjuk a protein belépett a csatornába. A fennmaradó részei a fehérjemolekula translotsiruemogo gyakran módosítják, miután átment a lumenbe. Ahhoz, hogy a fehérjét adhatunk oligosaharidtransferazoy cukorcsoportok, vagy a fellépés proteindisulfidizomerazy (PDI) képezhet diszulfidkötések a molekulában. Egyes fehérjék áthelyeződnek teljesen hasítottuk, közel a C-terminális része és a csatlakozó glikozilfos-fatidilinozitolu (GPI), egy foszfolipid, amely összeköti őket a membrán.
A lumen bejutását követően a fehérjék természetes eredetűek. Ezt számos különféle chaperon biztosítja. BiP és Grp94 közvetlenül kölcsönhatásba lépnek a strukturálatlan proteint. Kalneksin és kalretikulin kötődnek a cukor maradékok, amelyeket azért adnak az fehérjék transzlokáció során. Is részt vesznek, a folyamatot, hozzátéve a glükóz maradékot a polipeptid-lánc. A jelenléte a maradékot jelzi, mennyire jól a natív szerkezet a fehérje PDI-részt vesz az átrendeződés a diszulfid-kötések, amelyek kísérő strukturáló fehérje. Az akvizíció után fehérjék megfelelő natív szerkezete már nem reagálnak gardedámok és képesek kilépni az EPR a Golgi-készülék Ha több kísérlet kialakulását megfelelő natív fehérje szerkezetét nem jártak sikerrel vagy fehérje nem képez komplexet más fehérjék vissza a csatornára és vissza a citoszolba a retrográd transzlokáció miatt. Mikor lesz a citoszollai, akkor lebomlik a proteaszómát.
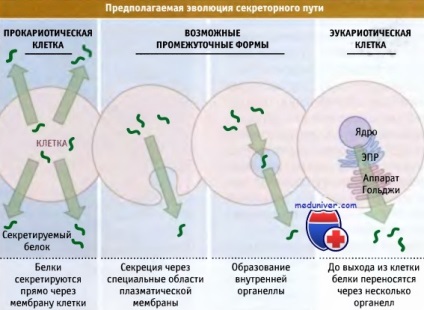
amely a fehérje szekréciójának a funkciója.
Eukarióta sejtekben a fehérjék nem közvetlenül szekretálódnak a plazmamembránon keresztül,
de a lumen EPR-be szállítják, ami összetételben hasonlít a sejt külső környezetére.
Az EPR nagy mennyiségű fehérje felhalmozódása, amely nem rendelkezik natív szerkezettel, a strukturálatlan fehérjék reakcióját okozza. Ez az EPR-től a magig terjedő jelek lánca, amelyek a chaperonok további szintézisét biztosítják. A jelet transzmembrán fehérjék, rezidens EPR komponensek közvetítik, amelyek felismerik a BiP-hez nem társuló strukturálatlan fehérjék jelenlétét. Ugyanakkor eseményeket váltanak ki, amelyek eredményeképpen a gének kifejeződése megváltozik, és az ESR képes leküzdeni a nem strukturált fehérjék feleslegének következményeit. Magasabb eukarióták esetén, a stressz folyamatos állapotában, ugyanezek a folyamatok sejtvesztést okoznak.
A fehérjéknek a mitokondriumokba és a kloroplasztusokba történő importja a fordítás vége után következik be. Mindkét organellát két membrán létezése jellemzi. A fehérjék lokalizálhatók az egyik membránban, az intermembrán térben vagy az organelle belsejében. Minden membránnak saját transzlokkája van. A mitokondriumokban a TOM a külső membránra és a TIM a belső membránra, valamint a kloroplasztok TOC-re és TIC-re utal. A jelszekvenciákat a külső membrán-transzlón ismerte fel. A belső és a külső membránok transzlokcói összekapcsolódnak, így az importált fehérjék közvetlenül egymás között kerülnek át. A mitokondriális fehérjék mindkét membránon keresztül szállíthatók, majd külön jelszekvencia felismerésekor ismét a belső membránra irányulnak.
A kloroplasztusok fehérjeinek transzlokációjakor a belső organelle membránján keresztül egy speciális szignálszekvencia is részt vesz, amelyet thakloidnak neveznek.
A fehérjék transzlokációja a mitokondriumokba az elektrokémiai gradiens a belső membránon keresztül, valamint az importált fehérjék és a chondronok között a mitokondriális mátrixban kialakuló interakciós erők következményei. Ennek következtében a kloroplasztokra történő áttelepítés nem tisztázott. Azt sem tudjuk, hogyan történik a fehérjék ezen szervek membránjainak integrálása.
A fehérjék peroxiszómákba történő szállítása poszttranszlációs módon fordul elő, de eltér a transzlokációtól a többi organelléig. Amikor peroxisómákba importálják, a fehérje áthalad egy membránon, és a folyamat akkor kezdődik, amikor a citoszolban natív szerkezetet szerzett. A peroxiszómák szignálszekvenciáját felismertük a citoszolban olyan proteinek részvételével, amelyek a transzlokáció idején kötődnek a szubsztráthoz. A fehérjék hordozói csak akkor válnak disszociálódnak, miután megjelentek az organelle belsejében, és visszatérnek a citoszolba további felhasználás céljából. A membránfehérjék peroxiszómák eredete ismeretlen.
Az import mellett. a fehérjék érése és eloszlása, az EPR számos funkciót végez a sejtben. Funkciói tükröződnek a struktúrában. A proteinek transzlokációja és érlelése granulált EPR-ben történik, riboszómákkal bevont. A sima EPR különbözik a granuláltól. Általában ez egy cső, dinamikus hálózatban, a citoszol elágazásán keresztül. A sima EPR gyakran kapcsolódik a citoszkeleton elemekhez és más sejtmembránokhoz is kapcsolódik. Funkciói közé tartozik a lipidek szintézise az összes sejtmembrán számára. A lipideket valahogy el kell szállítani az EPR-ből a többi membránra, de nem ismert, hogy ez hogyan történik. Lehetséges, hogy ez a sima EPR érintkezési pontjaiban más membránokkal történik. Az EPR az intracelluláris kalcium tartályaként is szolgál. A kalcium a sejt által kapott jelre válaszul jön létre, és a funkciók elvégzése után visszaviszi a szervetbe.
A sima EPR-ben lévő speciális sejtek zsírban oldódó hormonokat is szintetizálhatnak, vagy potenciálisan veszélyes kémiai vegyületeket semlegesíthetnek a sejt számára. Az EPR által végzett funkciók elvégzésére szakosodott sejtekben, például számos fehérje szekretálásában vagy szteroid hormonok kialakításában a granulált vagy sima EPR képződhet és a bennük lévő citoszol nagy részét elfoglalhatja. Az ilyen magasan specializált sejtekben, mint a vázizmokban, az ESR rendkívül erősen specializálódott összetételének és szerkezetének. A szarkoplazmatikus retikulum, amely egy speciális, sima EPR, a vázizmok szarkomerjei köré van tekercselve, és alkalmas arra, hogy kalciumionokat szállítson, amelyek serkentik az izomösszehúzódást.