Színes csíkok a tyler nienhouse-től
Dr. OV Mosin
A víz szokásos és szokatlan anyag. A bolygónk közel háromnegyedét óceánok és tengerek elfoglalják. Kemény víz - hó és jég - fedezte a terület 20% -át. A bolygó éghajlata a víz függvénye. A geofizikusok azt állítják, hogy a Föld régen lehűlt volna, és egy élettelen kődarabká változott volna, ha nem a vízért. Nagyon hőtároló kapacitása van. Melegítés esetén elnyeli a hőt; lehűl, ad. A felszín alatti víz elnyeli és sok hőmennyiséget visszakap, és ezáltal "lebeg" az éghajlatot. És a kozmikus hidegtől a Föld védi azokat a vízmolekulákat, amelyek szétszóródnak a légkörben - felhőkben és gőzök formájában.
A víz a természet legtávolabbi természete a DNS után, egyedülálló tulajdonságokkal, amelyek nemcsak nem teljesen magyarázhatók, de nem minden ismert. Minél tovább tanulmányozódik, annál több új anomáliát és rejtélyt találnak benne. A legtöbb ilyen anomáliák, biztosítva a lehetőséget a földi élet, magyarázza a vízmolekulák jelenlétében közötti hidrogén kötés van, amelyek sokkal erősebb, mint a Van der Waals vonzóerők között más anyagok molekuláit, de egy nagyságrenddel gyengébb, mint az ionos és kovalens kötések közötti atomok molekulák. Ugyanazok a hidrogénkötések is jelen vannak a DNS-molekulában.
A vízmolekula (H216O) két hidrogénatomot (H) és egy oxigénatomot (16O) tartalmaz. Kiderül, hogy a víz tulajdonságainak szinte minden változata és megnyilvánulásuk szokatlan természete végső soron az atomok fizikai természetével, molekulájukba való integrálásukkal és a képződött molekulák csoportosításával van meghatározva.
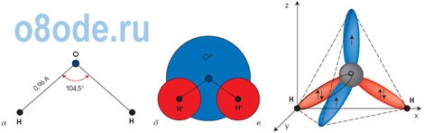
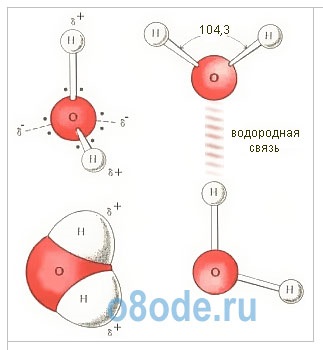
Ábra. A vízmolekula szerkezete. A H2O monomer geometriai sémája (a), planáris modellje (b) és térbeli elektronikus szerkezete (in). Két négy külső héj elektronok oxigénatomok részt vesz a kovalens kötések létrehozását és a hidrogénatomok, és a másik két formája egy erős hosszúkás elektron pályája síkban, amely merőleges arra a síkra, a H-O-H.
A vízmolekulát H2O háromszög alakjában állítja elő: a két oxigén-hidrogén kötés közötti szög 104 fok. De mivel mindkét hidrogénatom az oxigén egyik oldalán helyezkedik el, az elektromos töltések diszpergálódnak. A vízmolekula poláris, ami oka a különféle molekulák közötti speciális kölcsönhatásnak. A H2O molekulában a részleges pozitív töltésű hidrogénatomok kölcsönhatásba lépnek a szomszédos molekulák oxigénatomjainak elektronjaival. Az ilyen kémiai kötést hidrogénkötésnek nevezik. A H2O molekulákat a térszerkezet sajátos társultjai közé ötvözi; A sík, amelyben a hidrogénkötések találhatók, merőleges az ugyanazon H2O molekula atomjainak síkjára. A vízmolekulák közötti kölcsönhatás elsősorban az olvadás és a forralás indokolatlanul magas hőmérsékletét magyarázza. Szükséges további energiát hozni a rázáshoz, majd elpusztítani a hidrogénkötéseket. És ez az energia nagyon fontos. Ezért van a víz hőteljesítménye olyan nagy.
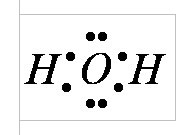
A hidrogén és az oxigénatomok elektronikus szerkezetének megfelelően a vízmolekula négy elektron párral rendelkezik. Ezek közül kettő két kovalens kötés kialakulásában vesz részt két hidrogénatomon, vagyis két kötődnek. A másik két elektronpár szabadon nem kötődik. Elektronikus felhőt alkotnak. A felhő nem egységes - különálló kondenzációkat és ritka frakciókat különböztet meg.
A vízmolekulában négy töltési pólus van: két pozitív és két negatív. A pozitív töltések koncentrálódnak a hidrogénatomoknál, mivel az oxigén elektro-negatív, mint a hidrogén. Két negatív pólus két nem kötődő oxigén elektronpárra esik.
Az oxigénmag felesleges elektronsűrűséget eredményez. A belső elektron-oxigénpár egyenletesen keretezi a magot: sematikusan ábrázolja az O2- centrum-maggal rendelkező kör. Négy külső elektront két elektron párra csoportosítanak, amelyek a mag felé gravitálnak, de részben nem kompenzálják. Szekvenciálisan ezeknek a pároknak az összes elektronikus pályáját ellipszisek formájában ábrázoltuk, amelyek a közös központból - az O2-magból nyúlnak ki. A fennmaradó két oxigén elektron egy gőzt képez egy elektron hidrogénnel. Ezek a párok az oxigénmagra is gravitálódnak. Ezért a hidrogénmag-protonok kissé csupaszak, és itt hiányzik az elektronsűrűség.
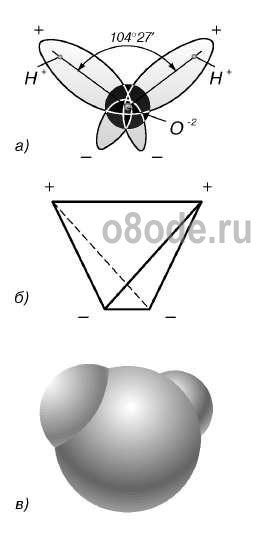
Ábra. A vízmolekula szerkezete: a - az O-H kötések közötti szög; b - töltősávok elhelyezkedése; c - a vízmolekula elektron-felhőjének megjelenése.
A szinte gömb alakú vízmolekulának van egy kifejezett polaritása, mivel az elektromos töltések aszimmetrikusak. Mindegyik vízmolekula egy miniatűr dipólum, amelynek nagy dipólus pillanata 1,87 Debye. A Debye egy 3.33564 · 1030 Cl-m-es dipólusú dipol kiépített egysége. A víz-dipólusok hatására a benne lévő anyag felületén lévő interatomikus vagy intermolekuláris erők 80-szoros csökkenést mutatnak. Más szavakkal, a víz magas dielektromos állandóval rendelkezik, amely a legmagasabb az összes ismert vegyület közül.
Ennek nagy része miatt a víz egyetemes oldószerként jelenik meg. A feloldódási hatásához bizonyos mértékig szilárd testek, folyadékok és gázok vannak.
A víz fajlagos hője a legnagyobb az összes anyag között. Továbbá, ez 2-szer magasabb, mint a jég, míg a legtöbb egyszerű anyagok (például a fémek) a fajhője olvadási gyakorlatilag változatlan, míg a vegyületek poliatomos molekulák általában csökken olvasztás során.
A molekula szerkezetének megértése lehetővé teszi a víz sok tulajdonságának, különösen a jég szerkezetének magyarázatát. A jég kristályrácsjában mindegyik molekulát négy másik veszi körül. Egy sík képen ez a következőképpen ábrázolható:
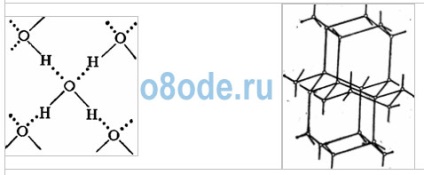
A molekulák közötti kötés hidrogénatomon keresztül valósul meg. Egy molekula víz pozitív töltésű hidrogénatomját vonzzák egy másik vízmolekula negatív töltésű oxigénjéhez. Ezt a kapcsolatot hidrogénnek nevezték (pontok jelölik). A hidrogénkötés erőssége körülbelül 15-20-szor gyengébb, mint a kovalens kötés. Ezért a hidrogénkötés könnyen megszakad, amit például a víz bepárlásakor figyelhetünk meg.
A folyékony víz szerkezete hasonlít a jég szerkezetére. Folyékony vízben a molekulák hidrogénkötésekkel is kapcsolódnak egymáshoz, de a vízszerkezet kevésbé kemény, mint a jég. A vízben lévő molekulák hőmozgásának köszönhetően bizonyos hidrogénkötések megszakadnak, mások alakulnak ki.
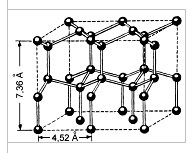
Ábra. Jég kristályos rács. A vízmolekulák H2O (fekete golyók) a csomópontjaiban úgy vannak elrendezve, hogy mindegyiknek négy "szomszédja" van.
A vízmolekulák polaritása, a részlegesen kompenzálatlan elektromos töltések jelenléte bennük azt a tendenciát eredményezi, hogy a molekulákat nagyobb "közösségek" - munkatársakká alakítják. Kiderül, hogy csak a víz, amely gőzállapotban van, teljesen megfelel a H2O képletnek. Ezt a vízgőz molekulatömegének meghatározása eredményezte. 0 és 100 ° C közötti hőmérséklet-tartományban a folyékony víz egyes (monomer molekuláinak) koncentrációja nem haladja meg az 1% -ot. Az összes többi vízmolekulát különböző mértékű komplexitású társulásokká alakítjuk, és összetételüket a (H2O) általános képletben írjuk le.
A társult vegyületek kialakulásának közvetlen oka a hidrogénkötések a vízmolekulák között. Felmerülnek egyes molekulák hidrogénmagjai és az egyéb vízmolekulák oxigénmagjainak elektronikus "kondenzációi" között. Igaz, ezek a kötések tízszer gyengébbek, mint a "standard" intramolekuláris kémiai kötések, és elegendő a szokásos molekulák mozgása, hogy elpusztítsák őket. De a termikus rezgések hatására könnyen létrejövő új típusú kapcsolódások is előfordulnak. A munkatársak eredete és bomlása a következő séma szerint fejezhető ki:
x · H 2O- (H 2O) x
Mivel az elektronvillanatok minden víz molekulájában tetraéderes szerkezetet alkotnak, a hidrogénkötések képesek a vízmolekulák elrendezését tetraéderes koordinált munkatársak formájában.
A legtöbb kutató elmagyarázza a folyékony víz abnormálisan magas hőkapacitását, mivel amikor a jég megolvad, kristályos szerkezete nem azonnal romlik le. Folyékony vízben a hidrogénkötések a molekulák között maradnak. Ebben maradnak jég - társak töredékei egy nagy vagy kisebb vízmolekulákból. Azonban, a jégtől eltérően, minden társult nem létezik sokáig. Folyamatosan egyesek megsemmisülnek és más munkatársak alakulnak ki. A víz hőmérsékletének minden értékénél dinamikus egyensúlyt állapít meg ebben a folyamatban. A víz melegítésével a hő egy részét a hidrogénkötések megszakítására fordítják a munkatársaknál. Ugyanakkor 0,26-0,5 eV elhasználódik, hogy megszakítsa az egyes csatlakozásokat. Ez megmagyarázza a víz rendellenes nagy hőteljesítményét a hidrogénkötéseket nem alkotó egyéb anyagok olvadásaival összehasonlítva. Amikor ezeket az olvadékokat felmelegítik, az energiát csak a termikus mozgásoknak az atomokhoz vagy molekulákhoz való kommunikációjában szabad felhasználni. A vízmolekulák közötti hidrogénkötések csak akkor törnek meg teljesen, ha a víz gőzbe változik. E szempont helyességét az is jelzi, hogy a vízgőz sajátos hője 100 ° C-on gyakorlatilag egybeesik a jég különleges hőmérsékletével 0 ° C-on.
Az alábbi kép:
A társult csoport elemi szerkezeti eleme a klaszter: Egy külön hipotetikus vízkészlet, különálló klaszterek alkotják a vízmolekulák (H2O) x: Fig. A vízmolekulák klaszterei társulnak.

Van egy másik szempont a víz rendkívül magas hőteljesítményének természetéről. Professzor G. N. Zatsepina észre, hogy a moláris fajhője a víz, 18 cal / (molgrad), pontosan megegyezik az elméleti moláris hőkapacitása szilárd anyagok, trihidroxi- kristályok. És összhangban a törvény a Dulong és Petit atomi fajhője kémiailag egyszerű (egyatomos) kristályos szilárd anyagok elegendően magas hőmérsékleten azonos, és egyenlő a 6 O kalDmol deg). És a triatomikus, grammolban, amely 3 Na rácsos helyet tartalmaz, 3-szor több. (Itt Na az Avogadro szám).
Ebből következik, hogy a víz egyfajta kristályos test, amely háromatomos H20 molekulákból áll. Ez megfelel a népszerű felfogás a víz, mint az elegy kristály társult kis mennyiségű szabad vízmolekulák H2O közöttük, amelyek száma növekszik a hőmérséklet emelkedésével. Ebből a szempontból meglepő, hogy nem a folyékony víz magas hőteljesítménye, hanem az alacsony szilárd jég. Csökkentése fajhője a víz fagyasztás során hiánya miatt a keresztirányú termikus rezgések az atomok a kristályrácsban merev jég, ahol minden egyes proton okoz hidrogén kötést, csak egy szabadságfokot termikus rezgések három helyett.
De miért és hogyan tudnak ilyen nagy változások a víz hőteljesítményében a megfelelő nyomásváltozás nélkül? A kérdés megválaszolásához ismerkedjünk meg a Yu.A. Kolyasnikov geológiai és ásványtani tudomány kandidátusa hipotézisével a víz szerkezetéről.
Azt rámutat, hogy még akkor is felfedezők hidrogénkötések J. F. Bernal és Fowler 1932 g. Szerkezete folyékony víz összehasonlítva a kristályszerkezet kvarc, és azok társult, mint már említettük, -. Elsősorban tetramereket 4H20, amelyben négy vízmolekulák egy tizenkét belső hidrogénkötésű kompakt tetraéderrel. Ennek eredményeképpen tetraéderes piramis alakul ki.
Ebben az esetben, a hidrogénkötések ezekben tetramereket képezhetnek mind a jobb- és balkezes, így egy olyan szekvenciát, mint kristályos elterjedt kvarc (Si02), továbbá amelynek a tetraéderes szerkezetű jobb és bal forgási kristályos formák. Mivel minden egyes tetramer még mindig a víz és a négy nem használt külső hidrogén kötések (például egy vízmolekula), a tetramerek is csatlakoztatható ezen külső kapcsolatok egyfajta polimer lánc, mint például egy DNS-molekula. Mivel csak négy, külső kapcsolatok és a belső - 3-szor, ez lehetővé teszi, hogy a kemény és tartós tetramerek a folyékony víz hajlított, forgatható és még nadlamyvayutsya e gyengített termikus rezgések külső hidrogénkötések. Ez okozza a víz folyékonyságát.
Egy ilyen struktúra, Kolyasnikov véleménye szerint a víz csak folyékony állapotban van, esetleg részleges gőzzel. De a jég kristályszerkezet, amely alaposan tanulmányozták, tetragidroli összekapcsolt merev equiresistant közvetlen hidrogén-kötéseket egy áttört szerkezet nagy üregek benne, ami a jég sűrűsége kisebb, mint a víz sűrűsége.

Amikor a jég megolvad, a benne lévő hidrogénkötések egy része gyengül és flexibilis, ami a szerkezet felépítéséhez vezet a fent leírt tetramerekbe, és a folyékony vizet sűrűbbé teszi, mint a jég. 4 ° C-on állapot akkor következik be, amikor a tetramerek közötti összes hidrogénkötés maximálisan ívelt, ami oka a víz maximális sűrűségének ezen a hőmérsékleten. További kommunikáció a hajlításhoz nincs helye.
Feletti hőmérsékleten 4 ° C-on kezd könnyezés közötti kötések az egyes tetramerek, és 36-37 ° C-on szakadt fele hidrogénkötések. Ez határozza meg a víz meghatározott hőmérsékletének és a hőmérsékletnek a minimális görbéjét. Amikor a hőmérséklet 70 ° C megszakította szinte minden szálat mezhtetramernye, valamint ingyenes és tetramerek a vízben már csak rövid foszlányait „polimer” láncok őket. Végül a víz forrásával az egyetlen tetramerek teljesen felbomlanak egyes H20 molekulákká. És az a tény, hogy a fajhője víz párolgása pontosan 3-szor nagyobb, mint az összege az adott melegíti az olvadó jég víz és az azt követő melegítés 100 ° C-on, egy megerősítő Kolyasnikova feltételezés. hogy a tetramerben lévő belső kötések száma 3-szor nagyobb, mint a külső kötések száma.