A kémia gumi képlete
A gumi meghatározása és képletje
A gumik elasztikus anyagok, amelyek vulkanizálásával (kénnel történő melegítéssel) gumi keletkezik.
Vannak természetes (természetes) és szintetikus gumik, melyek mindegyikét rugalmasság, vízzáróság és elektromos szigetelési tulajdonság jellemzi.
Természetes (a kémiai összetételű természetes kaucsuk nagy molekulatömegű telítetlen szénhidrogén (C5H8) n, ahol n értéke 1000-3000. A természetes gumi izoprén polimer:
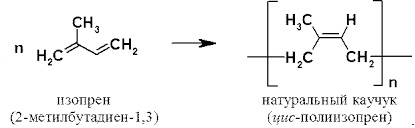
A természetes gumi előállításához szükséges nyersanyagok a Hevea, Kok-Sagisa stb. Az ilyen gumi szén-diszulfiddal, benzinnel, benzollal és kloroformmal oldódik fel.
Az ipari méretű szintetikus gumiat először 1932-ben szerezték meg a Szovjetunióban SV Lebeyev módszerével. Ezt a divinil polimerizációjával nyerik. A katalizátor (fém-nátrium) jelenlétében lejátszódó polimerizációs folyamat a következőképpen fejezhető ki:
A szintetikus gumi Lebedev módszerével nyert nyersanyag az etil-alkohol. Napjainkig számos más módszert fejlesztettek ki butadién előállítására, például butánból katalitikus dehidrogénezés útján.
Példák a problémamegoldásra
Bizonyos mennyiségű szénhidrogén teljes égetésével 14,08 g (IV) szénmonoxidot és 3,6 g vizet hoztak létre. Találd meg az anyag molekuláris képletét, ha a gőz viszonylagos sűrűsége a hidrogén fölött 39.
Az "x", az "y", a "z" és a "k" szimulált szén, hidrogén, oxigén és nitrogénatomok számát jelöli az aminosav égési reakciójának rendszere:
Meghatározzuk az anyagot alkotó elemek tömegeit. Az időszakos táblázatból vett relatív atomtömegek értékei Mendelejev, egész számra kerekítve: Ar (C) = 12 amu. Ar (H) = 1 amu Ar (O) = 16 amu.
Számítsuk ki a szén-dioxid és a víz móltömegét. Mint ismeretes, egy molekula móltömege megegyezik a molekulát alkotó atomok (M = Mr) relatív atomtömegének összegével:
M (CO2) = Ar (C) + 2 × Ar (O) = 12 + 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol
m (C) = [14,8 / 44] x 12 = 4,04 g;
m (H) = 2 × 3,6 / 18 × 1 = 0,4 g
Határozzuk meg a szénhidrogén kémiai képletét:
x: y = m (C) / Ar (C). m (H) / Ar (H);
Így a legegyszerűbb képlet CH, és a moláris tömeg 13 g / mol [M (CH) = Ar (C) + Ar (H) = 12 + 1 = 13 / mol].
A szerves anyag móltömegét hidrogén sűrűségével határozhatjuk meg:
Msubstance = 2 × 39 = 78 g / mol
A szerves vegyület valódi képletének megtalálásához megtaláltuk a kapott móltömegek arányát:
Msubstance / M (CH) = 78/13 = 6
Tehát a szén- és hidrogénatomok mutatóinak 6-szorosnak kell lenniük, azaz. az anyag formulája C6H6 formában van, ez a benzol.