Kénsav (szulfát) sav és sói
A H2S04 színtelen olajos folyadék, a 98% -os oldat sűrűsége 1,84 g / cm, nem illékony és nincs szaga. Rendkívül higroszkópos, könnyen felszívja a vizet. Az oldódás során nagy mennyiségű hőt szabadít fel.
Kémiai tulajdonságok: 1. Erős sav, két lépésben szinte 100% -ban bomlik ionokká, két sávot képez.
HSO4 - ↔ H + + SO4 2-szulfátion
A hígított savas H2S04 a savak összes közös tulajdonsága: megváltoztatja a mutatók oldatainak színét); kölcsönhatásba lép a bázisokkal, bázikus oxidokkal és sókkal (ioncserélő reakciók, nem IRP!):
Mindezekben a reakciókban a fő szerepet a hidrogénionok játsszák, és az SO4 2- egyszerűen jelen van az oldatban. Az SO4 2-ion (azaz kénsav és sói) specifikus reakciója a báriumsókkal való reakció.
2H + + SO4 2- + Ba2 + + 2Cl - → 2H + + 2CI - + BaS04 ↓
Ezt a reakciót "kémiai reakciónak" nevezik kénsavnak és sóinak, mivel benne BaS04 jellegzetes finom kristályos fehér csapadék képződik. A reakciót laboratóriumi gyakorlatban alkalmazzuk, hogy meghatározzuk az SO4 2- ion oldatának jelenlétét.
Fémekkel való kölcsönhatás esetén a kénsav különböző módon viselkedhet a fém koncentrációjától és aktivitásától függően.
A hígított H2S04-ben az oxidálószer a H + ion. ezért a híg kénsav kölcsönhatásba csak olyan fémekkel történik, amelyek egy sor feszültség alatt állnak hidrogénhez, és az egyik reakciótermék hidrogéngáz.
Zn 0-2e - → Zn + 2 H + + e - → H 0
De ha vesszük a tömény sav, akkor fog működni, mint egy oxidálószer S 6. és ehelyett megkapjuk a hidrogén-termék visszanyerése ez - néhány kénvegyület. Milyen? A fém aktivitásától, hőmérsékletétől és savkoncentrációjától függ. Általában ilyen anyagok keverékét képezik. Azonban, egyszerűsítése, abból lehet kiindulni, hogy a több, aktív fém, a mélyebb a helyreállítási folyamat, és a mértéke a kén oxidációs reakciótermék alacsonyabb lesz. Azt is meg kell jegyezni, hogy a tömény H 2SO 4 kölcsönhatásba minden fém a arany és platina, de a hideg vas, alumínium és króm passzivált (nem reagálnak képződése miatt szilárd film a fém felületén), és néhány fémek nem reagál a híg kénsavval sav (ha ebben az esetben oldhatatlan sót képzünk).
H2S04 (conc.) + Ca → CaSO4 + H2O + CaS Ca 0-2e - → Ca 2+ S + 6 + 8e - → S -2
H2 SO4 (konc.) - erős oxidálószer, és oxidálja nemcsak fémeket, hanem a nem-fémek és vegyületeik, sőt, elszenesedik szerves anyagok (mivel a víz összegyűlik, például, szénhidrátok)
C 0-4e - → C 4 + S + 6 + 2e - → S +4

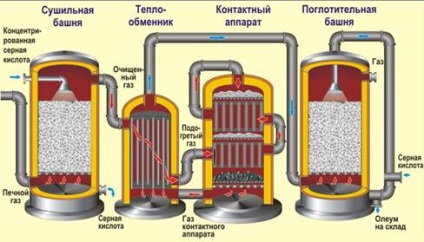
1) pirite kalcinálása (a hőcserés elve, a "forrásban lévő rétegben", a levegő oxigénnel dúsul):
2) kén-dioxid katalitikus oxidációja (450 ° C, V2O5 katalizátor, vanádium-oxid (V), ellenirányú elv):
A végtermék koncentrált H2SO4-ban "oleum" - SO3 oldat.
A kénsav előállítása során kén-dioxidot gyakran használnak színes érc, tüzelőanyag vagy szabad kén égetésekor. Ie Az első szakasz kicsit más lehet, de az utolsó kettő mindig ugyanaz.
Alkalmazás. A kénsav a vegyipar "kenyere".
- K2S04 és (NH4) 2S04 - kálium - és ammónium - szulfátok, a mezőgazdaságban ásványi trágyákként
- CuSO4 # 8729; 5H2 O - réz-szulfát, a s / x, mint egy olyan növényi betegségek leküzdéséhez, a könnyűipari, mint a színezék, az építőiparban, mint egy gombaellenes szer a electroforming (bevonatréteg réz)
FeSO4 # 8729; 7H2O - vas vitriol, a növényi kártevők elleni védekezéshez használt mezőgazdasági eszközökkel, a könnyűiparban a textíliák festésénél.
CaSO4 # 8729; 2H2O - ásványi gipsz, építési felhasználásban "égetett gipsz" 2CaSO4 # 8729; H2O az alabástrom név alatt a gitt, a gyógyszerek - penészgombák, gumiabroncsok, a művészeti és iparművészeti alkotások összetételében.
na2 SO4 # 8729; 10H2O - Glauber sója, az orvostudományban hashajtóként, üveggyártásban
BaSO4 - az orvostudományban, (a gyomor röntgensugárzása), a papírgyártásban, a gumi töltőanyagként
2) színesfém kohászat (hidrometallurgia, réz, nikkel stb.) És fémfeldolgozás (nyomtatott áramköri lapok, galvanizálás, akkumulátorok stb.)
3) szervetlen szintézis (ásványi trágyák, pigmentek, savak előállítása ...) és szerves szintézis (színezékek, robbanóanyagok, polimerek előállítása ...)
4) papírgyártás
5) szóda (üveg, CMC) előállítása
A kénsav sói nem rendelkeznek oxidatív tulajdonságokkal, lépjenek be a szokásos ioncserélő reakcióba.