Abszorpciós spektrumok és szervetlen anyagok színe
Nem minden szerves anyag színes. Azonban azokban az anyagokban, amelyek színnel rendelkeznek, alapvető molekulaszerű hasonlóság van. Mindegyikük általában, több tucat atomból álló nagy molekulák. A szín megjelenése, nem az egyes atomok elektronjai, hanem az elektron molekuláris rendszerének állapota, amely magában foglalja az egész molekulát. Az ilyen rendszer mobilitása, képes arra, hogy könnyen megváltoztassa állapotát a fénykvantumok kis hatása alatt, és bizonyos hullámok szelektív felszívódását okozza a látható fényből.
Annak érdekében, hogy megértsük a kromaticitás függőségét a szerkezetre, meg kell fontolni, hogy milyen molekulák egyfajta molekulák energiaállapota jellemzői.
Abszorpciós spektrumok és szervetlen anyagok színe
Az anyagnak ez a színe azt jelenti, hogy a fűrészelt fény hullámhossza 400-700 nm-es intervallumától kezdve bizonyos kvantumokat abszorbeál, melynek energiája általában nem túl nagy.
Ebből viszont az következik, hogy a színes anyagok molekuláiban az elektronok energiaszintje meglehetősen szoros távolságban van. Ha a különbség # 916; E nagy, akkor más kvantumokat használnak, amelyek több energiát hordoznak, például ultraibolya. Az olyan anyagok, mint a nitrogén, a hidrogén, a fluor, a nemesgázok, színtelennek tűnnek. A látható fény kvantumait nem szívják fel, mivel nem képesek az elektronokat magasabb izgalomba hozni. Ha a szemünk képes volt érzékelni az ultraibolya sugárzást, akkor ilyen ultraibolya fényben a hidrogén, a nitrogén és az inert gázok színeznek.
Minél több elektron van egy atomban, annál közelebb vannak egymás elektronikus szintjei. Különösen jó, ha vannak olyan pályák, amelyeket egy atom atomjai nem foglalnak el. Ebben az esetben egy elektron átkapcsolása egyik állapotról a másikra, a fényspektrum már alacsonyabb energiával rendelkezik, amelyet a spektrum látható részének sugarai hordanak. Ilyen multi-elektron halogén, például klór, bróm, jód már színes. Nitrogén-oxidok NO2, N2O3 és kovalens vegyületek, például CuCl2, AlI3, színezettek. A több atomból álló molekulák (1. ábra) színezése számos tényezőtől függ. Ha ezeknek a tényezőknek a hatása olyan, hogy összehozza az elektronikus szinteket, akkor ez hozzájárul a szín megjelenéséhez vagy elmélyítéséhez. Így az atomok közelebbi kölcsönhatása a gázhalmazállapotú folyadéktól a folyadékig, majd a szilárd állapotig elősegítheti a megjelenést vagy
a színek elmélyülése, különösen azokban az esetekben, amikor az atomok keringenek nem elektronokat foglalnak el.
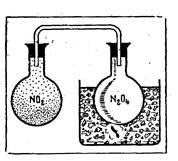
Ábra. 1. A nitrogén-oxid (IV) színét hűtéssel eltűnik (N2O4 dimer képződik), és újra megjelenik melegítéskor.
Az interakció természetének különbsége befolyásolja a spektrumot. A legegyszerűbb molekuláris vegyületek - a gázok és a gázállapotú anyagok - abszorpciós spektrumai több sor keskeny sávból (vonalakból) állnak. Ez azt jelenti, hogy a fehér fény teljes áramából kifolyólag csak bizonyos fotonokat választanak, amelyek energiája éppen egyenlő a földi állapot és az elektronok "izgatott" állapotai közötti különbséggel. A folyadékban és különösen szilárd állapotban a spektrum lényegében folyamatos, mivel a szorosan elhelyezkedő atomok erős kölcsönhatása miatt számos új energiaszint jelenik meg, következésképpen az új elektronikus átmenetek lehetősége nő, a molekulák és ionok energiaszintjeinek száma nő. A spektrum számos olyan széles sávot tartalmaz, amelyek több tucat nanométerrel terjednek ki. A sávok intenzitása és egymás közötti szuperpozíciójuk meghatározzák az anyag végső színét. Végtére is, az elsődleges színek különböző kombinációival: vörös, kék, zöld vagy piros, sárga, kék, a spektrum minden más színét kapjuk.
Rendszerint a szervetlen anyagok felszívódási sávjai a látható tartományban kezdődnek, és végül az ultraibolya sugárzási tartományban fejeződnek be. A legerősebb abszorpciós sávok elhelyezkedése meghatározza a színt (1. táblázat).

Az anyag színe a visszavert hullámok összegéből áll (vagy haladéktalanul átadja az anyagot), és ezek vagy más hullámok intenzitása eltérő lehet. Ezért még akkor is, ha a spektrum ugyanolyan hullámokból áll, de a spektrumban lévő relatív frakciójuk megváltozik, akkor különböző színű anyagokat látunk. A spektrumban egymással kombinálódó sugarak eltérő színt adnak. Íme egy példa. A kadmium és a higany a Periodikus rendszer II. Csoportjának ugyanazon alcsoportjába tartozik. Az atomok egymástól különböznek a belső elektronok számától. HgS és CdS szulfidjaik erősen elnyelik a spektrum ibolyaszínű részének sugarát, és sokkal gyengébbek - vörös-narancssárga (2. ábra). A tükröződés látszólag elhanyagolható eltérése miatt újabb kombináció érhető el: a kadmium-szulfid sárgának tűnik, a higanyszulfid pedig narancssárga.
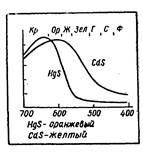
2. ábra. Az abszorpciós spektrum különbsége határozza meg a színt.
Az ábra több anyag spektrumát mutatja, amelyekben a látható fény különbözõ részei hullámainak visszaverõdésének intenzitása eltérõ. A 3. ábrán látható, hogy milyen arányban látjuk ezt a színt. Abban az esetben, ha a görbék metszik egymást, a színek kölcsönösen "elpusztítják" egymást, és csak a maradandó színt látjuk. Amikor a szín tükröződik 480 nm-es hullámhosszal, az anyag kék, mivel a piros és a zöld színek egymást elpusztítják. 500 nm - zöld, 600 nm felett - vörös, sárgás színű. A különféle okrakkól származó színérzetet (amelyet például színes stek-kol alkalmazásával kapunk meg) teljes egészében érzékelünk.
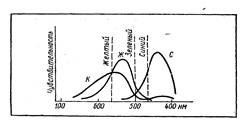
Ábra. 3. A látható szín az a következménye, hogy az elsődleges színeket a három idegcentrumnak megfelelővé teszik, ami piros, zöld és kék érzést eredményez.
A szervetlen festékek szilárd állapotának jellemzői
Először is emlékeztetni kell arra, hogy a szervetlen színezékek, mind természetes, mind szintetikus, kristályos testek. Ezek egyik jellemzője sok száz és ezer atom, ás vagy molekula rendezett elrendezése. Különbözőek a szilárd testbe belépő részecskék típusában és a köztük lévő kémiai kötések típusában.
Annak érdekében, hogy megértsük struktúrájukat, vegyük fontolóra példákat az egykori vagy más típusú, az iskolai kémiai tanfolyamon ismertté vált állapotok építésének jellemzőiről.
Gázállapotban az anyagokat a részecskék és a köztük lévő kis kölcsönhatások között jelentős távolságok jellemzik. Tudnak bármilyen mennyiséget felvenni, és tulajdonságait alapvetően az egyes részecskék viselkedése határozza meg. A folyékony állapotban az anyagok részecskéit közelebb hozzák a dimenziójuknak megfelelő távolságokhoz, a kölcsönhatási erők a részecskék között jelentősek. Az anyag részecskéi nagy aggregátumokká alakulnak, amelyekben viszonylagos elrendezésük rendezett, és a mozgás oszcilláló jellegű (rövid hatótávolságú rend). Az aggregátumok központjaitól nagy távolságra (hosszú távú rend) ez a megrendelés sérül. A folyadékban lévő részecskék aggregátumai közötti kötések szilárdsága alacsony, ezért folyékony állapotban az anyag egy bizonyos térfogatot foglal magában, de alakja megváltoztatható a gravitáció hatása alatt. Az anyagok ebben az állapotban történő viselkedését mind a részecskék, mind az aggregátumok tulajdonságai, mind a köztük levő kölcsönhatások határozzák meg.